
【题目】下图一所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液,足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极。
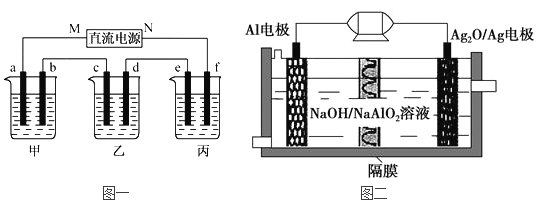
(1)图一中的直流电源为一种性能优良的Al-Ag2O电池,其原理如图二所示。该电池中铝是负极,试写出电池工作时的正极反应式__________________和电池的总化学反应方程式______________。
(2)接通电源后,经过一段时间后,测得丙中K2SO4质量分数为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为_______极;c电极上发生______反应(“氧化”或“还原”);
②电极b上发生的电极反应为___________________;
③列式计算电极b上生产的气体在标准状况下的体积_______;
④电极c的质量变化是_____g;
⑤电解前后各溶液的pH是否发生变化(“增大”、“减小”或“不变”)
甲溶液_________;乙溶液_________;丙溶液______________。
【答案】 Ag2O+2e-+H2O=2Ag+2OH- 2Al+3Ag2O+2NaOH═2NaAlO2+6Ag+H2O 正 还原 4OH--4e-=2H2O+O2↑ 2.8L 16g 增大 减小 不变
【解析】(1)在Al-Ag2O电池中负极铝上的电极反应式为2Al-6e-+4OH-═2AlO2-+2H2O,正极反应式为Ag2O+2e-+H2O=2Ag+2OH-,总反应为2Al+3Ag2O+2NaOH═2NaAlO2+6Ag+H2O,故答案为:Ag2O+2e-+H2O=2Ag+2OH-;2Al+3Ag2O+2NaOH═2NaAlO2+6Ag+H2O;
(2)①乙杯中c质量增加,说明Cu沉积在c电极上,电子是从b-c移动,M是负极,N为正极,c为阴极,发生还原反应,故答案为:正极;还原;
②甲中为NaOH,相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
③丙中为K2SO4,相当于电解水,设电解的水的质量为x.由电解前后溶质质量相等有,100×10%=(100-x)×10.47%,得x=4.5g,故为0.25mol.由方程式2H2+O2═2H2O可知,生成2molH2O,转移4mol电子,所以整个反应中转化0.5mol电子,则生成O2为0.5/4=0.125mol,标况下的体积为0.125×22.4=2.8L,故答案为:2.8L;
④整个电路是串联的,所以每个烧杯中的电极上转移电子数是相等的,根据电极反应:Cu2++2e-=Cu,可知转移0.5mol电子生成的m(Cu)= ![]() ×64=16g,故答案为:16;
×64=16g,故答案为:16;
⑤甲中相当于电解水,故NaOH的浓度增大,pH变大;乙中阴极为Cu2+放电,阳极为OH-放电,电解方程式为:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,所以H+增多,故pH减小;丙中为电解水,对于K2SO4而言,其pH几乎不变,故答案为:增大;减小;不变。
2Cu+O2↑+2H2SO4,所以H+增多,故pH减小;丙中为电解水,对于K2SO4而言,其pH几乎不变,故答案为:增大;减小;不变。


科目:高中化学 来源: 题型:
【题目】若用肠液(含有蛋白质水解酶)处理果蝇唾液腺的巨大染色体,得到一连续的极细长的纤丝,此纤丝可能是
A. 染色质丝 B. 多肽链 C. DNA分子 D. 氨基酸和核苷酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中Cl-的物质的量浓度最大的是
A.200mL 2mol·L—1MgCl2溶液B.500mL 2.5mol·L—1NaCl溶液
C.30mL 2.5mol·L—1CaCl2溶液D.250mL 1mol·L—1AlCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示。已知:pM=-lgc(M),p(CO32-)=-lgc(CO32-)。下列说法正确的是( )
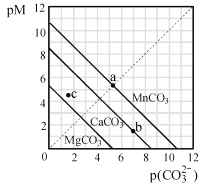
A. MgCO3、CaCO3、MnCO3的Ksp依次增大
B. a点可表示MnCO3的饱和溶液,且c(Mn2+)=c(CO32-)
C. b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-)
D. c点可表示MgCO3的不饱和溶液,且c(Mg2+)>c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月18日中共中央国务院公开致电祝贺南海北部神狐海域进行的“可燃冰”试采成功。“可燃冰”是天然气水合物,外形像冰,在常温常压下迅速分解释放出甲烷,被称为未来新能源。
(1)“可燃冰”作为能源的优点是__________(回答一条即可)。
(2)甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整两个过程。向反应系统同时通入甲烷,氧气和水蒸气,发生的主要化学反应如下:
反应过程 | 化学方程式 | 焓变△H(kJ.mol-l) | 活化能E.(kJ.mol-1) |
甲烷氧化 | CH4(g)+O2(g) | -802.6 | 125.6 |
CH4(g)+O2(g) | -322.0 | 172.5 | |
蒸气重整 | CH4(g)+H2O(g) | +206.2 | 240.1 |
CH4(g)+2H2O(g) | +158.6 | 243.9 |
回答下列问题:
①在初始阶段,甲烷蒸汽重整的反应速率______(填“大于”“小于”或“等于”)甲烷氧化的反应速率。
②反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图所示。
CO(g)+3H2(g)的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图所示。

该反应在图中A点的平衡常数Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),图中压强(p1、p2、p3、p4)由大到小的顺序为___________。
③从能量角度分析,甲烷自热重整方法的先进之处在于___________。
④如果进料中氧气量过大,最终会导致H2物质量分数降底,原因是__________。
(3)甲烷超干重整CO2技术可得到富含CO的气体,其能源和开境上的双重意义重大,甲烷超干重整CO2的催化转化原理如图所示。

①过程II中第二步反应的化学方程式为_____________。
②只有过程I投料比![]() _______,过程II中催化剂组成才会保持不变。
_______,过程II中催化剂组成才会保持不变。
③该技术总反应的热化学方式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳条结寒翠,请君添暖衣。深秋及寒冬的清晨,我们池州市经常出现大雾天气,关于雾中小液滴直径范围是( )
A.小于1nmB.在1~100cm间C.大于100nmD.在1~100nm间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组学生利用如图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl36H2O晶体。(图中夹持及尾气处理装置均已略去)

(1)装置B中发生反应的化学方程式是______。
(2)装置E中的现象是______。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。写出可能发生的有关反应化学方程式:______。
(4)该小组学生利用上述滤液制取FeCl36H2O晶体,设计流程如图所示:
![]()
①步骤I中通入Cl2的作用是________。
②简述检验滤液中Fe3+的操作方法_______。
③步骤Ⅱ从FeCl3稀溶液中得到FeCl36H2O晶体的主要操作包括:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸溶液的pH=1,此酸溶液的物质的量浓度( )
A. 为0.1 mol/L
B. 一定大于0.1 mol/L
C. 若为强酸一定等于0.1 mol/L,若为弱酸一定大于0.1 mol/L
D. 若为强酸一定小于或等于0.1 mol/L,若为弱酸一定大于0.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在试管a中先加入3mL95%的乙醇,边摇动边缓缓加入2mL浓H2S04并充分摇匀,冷却后再加入2mL冰醋酸,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入 7mL饱和碳酸钠溶液。连接好装置。用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验。
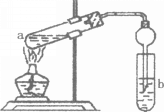
①加入浓H2S04的作用是_________________________;
②试管b中观察到的主要现象是_________________________________;
③在实验中球形干燥管除起冷凝作用外,另一个重要作用是______________;
④饱和Na2C03溶液的作用是_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com