
(1)在一定温度和压强下,1体积X2(g)和3体积Y2(g)化合生成2体积Z(g),则Z气体的化学式是________。
(2)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为________。若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为________。
(3)相同条件下,某Cl2与O2混合气体100 mL恰好与150 mL H2化合生成HCl和H2O,则混合气体中Cl2与O2的体积比为________,混合气体的平均相对分子质量为________。
(4)现有m g某气体,它的摩尔质量为M g·mol-1,则
①该气体溶于1 L水中(不考虑反应),其溶液中溶质的质量分数为________。
②该气体溶于水后形成V L溶液,其溶液的物质的量浓度为______ mol·L-1。
(1)XY3 (2)27.6% 48.3% (3)1∶1 51.5
(4)①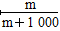 ×100% ②
×100% ②
【解析】(1)根据阿伏加德罗定律可写出化学方程式:X2+3Y2=2Z,再根据质量守恒定律,可得Z的化学式应为XY3。
(2)三种气体的平均相对分子质量为14.5×2=29,因CO与N2的相对分子质量相同,求算平均相对分子质量时可一并考虑,设O2的物质的量分数为x,则CO和N2的物质的量分数为(1-x),因此有:32x+28(1-x)=29,解得x=0.25。O2的质量分数为 ×100%=27.6%。
×100%=27.6%。
若CO和N2的物质的量之比为1∶1,设混合气体为1 mol,则混合气体中氧的物质的量为:0.25 mol×2+(0.75 mol÷2)×1=0.875 mol,氧元素的质量分数为 ×100%=48.3%。
×100%=48.3%。
(3)设Cl2的体积为x mL,则O2的体积为(100-x)mL。
根据反应H2+Cl2 2HCl、2H2+O2
2HCl、2H2+O2 2H2O知,反应中消耗的H2为:xmL+2(100-x)mL=150 mL,解得x=50 mL。因此n(Cl2)∶n(O2)=1∶1。体积百分含量各占50%。混合气体的平均相对分子质量为:71×50%+32×50%=51.5。
2H2O知,反应中消耗的H2为:xmL+2(100-x)mL=150 mL,解得x=50 mL。因此n(Cl2)∶n(O2)=1∶1。体积百分含量各占50%。混合气体的平均相对分子质量为:71×50%+32×50%=51.5。
(4)①1 L水的质量是1 000 g。m g该气体溶于1 L水中,所得溶液中溶质的质量分数是:w= ×100%=
×100%=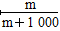 ×100%。
×100%。
②V(aq)=V L,则c=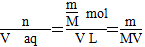 mol·L-1。
mol·L-1。


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com