
能正确表示下列反应的离子方程式为
A.硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S
B.NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO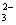 +H2O
+H2O
C.少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O=C6H5OH+HSO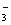
D.大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
某同学用回收的镁铝合金制取氢气.现有l0.8g镁铝合金,下列说法正确的是( )
|
| A. | 常温下与足量18mol/LH2SO4反应,最多可放出0.6 mol H2 |
|
| B. | 常温下与足量2mol/LHNO3反应,最少可放出0.45 mol H2 |
|
| C. | 常温下与足量2 mol/L H2SO4反应,放出H2的量在0.45 mol~0.6 mol之间 |
|
| D. | 常温下与足量2mol/LNaOH反应,放出H2的量在0.45 mol~0.6 mol之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
从海水中提取镁是世界各国获得镁的主要来源,以下是制取镁的过程中涉及的几种物质的溶度积,根据你所学的知识回答下列几个问题:
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 |
| 溶度积 | 2.8×10﹣9 | 6.8×10﹣6 | 5.5×10﹣6 | 1.8×10﹣11 |
(1)在从海水中提取镁时,往往用到贝壳(主要成份是碳酸钙),你认为 不能 (填“能”或“不能”)将贝壳研磨成粉末直接投入海水中,理由是 贝壳研磨成粉末仍是CaCO3,由于CaCO3比MgCO3还要难溶,所以将其直接投入海水中不能产生MgCO3 ;如果不能直接投入,应将贝壳作何处理,试写出化学方程式 CaCO3\frac{\underline{\;高温\;}}{\;}CaO+CO2↑ .
(2)某同学在实验室条件下模拟该生产过程,但实验室无石灰,他打算用烧碱代替,你认为 可以 (填“可以”或“不可以”)得到Mg(OH)2.在加试剂时,误将纯碱溶液加入海水中,他思考了一下,又在得到的混合体系中加入过量的烧碱溶液,你觉得他 能 (填“能”或“不能”)将Mg2+转化为Mg(OH)2沉淀,理由是 Mg2++CO32﹣=MgCO3 MgCO3+2OH﹣=Mg(OH)2+CO32﹣ .(用离子方程式表示)
(3)已知海水中镁离子浓度为1.8×10﹣3mol/L,则要使镁离子产生沉淀,溶液的pH最低应为 10 .
查看答案和解析>>
科目:高中化学 来源: 题型:
有两种位于短周期的相邻周期、相邻主族的非金属元素X、Y,已知两元素最高价氧化物的水化物均为强酸.根据下图转化关系(反应条件及部分产物已略去),回答下列问题:
(1)若A、B、C、D均为含X元素的化合物,且A、F的一个分子中都只含有10个电子,则:
①A分子的空间构型为 三角锥形 ,F分子的电子式为 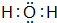 .
.
②反应 I 的化学方程式为 4NH3+5O2 4NO+6H2O .
4NO+6H2O .
③化合物NaX3是合成“达菲”的中间活性物质,也是汽车安全气囊中的主要物质.NaX3受撞击后生成Na3X和另一种气体单质,请写出该反应的化学方程式 3NaN3=Na3N+4N2↑ .
④X的氧化物是形成光化学烟雾原因之一,工业上可采用它与其氢化物反应生成无毒害物质而除去,请用方程式表示该反应 6NOx+4xNH3=(3+2x)N2+6xH2O .
(2)若A、B、C、D均为含Y元素的化合物,其中A由两种元素组成,且A的摩尔质量为120g•mol﹣1,则:
①将反应IV所得的溶液加热蒸干得到的晶体属于 离子 晶体(填“离子”、“分子”、“原子”)
②反应 I 的化学方程式为 4FeS2+11O2 2Fe2O3+8SO2 .
2Fe2O3+8SO2 .
③含Y元素的化合物Na2Y和次氯酸钠溶液在强碱性环境中能发生反应,产物无沉淀,请写出该反应的离子反应方程式 S2﹣+4ClO﹣=SO42﹣+4Cl﹣ .

查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质在指定条件下电离方程式正确的是 ( )
A.Na2CO3溶于水 Na2CO3===Na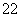 +CO
+CO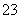
B.Al(OH)3酸式电离 Al(OH)3===H++AlO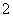 +H2O
+H2O
C.NaHS溶于水HS-的电离 HS-+H2O H2S+OH-
H2S+OH-
D.NaHCO3加热熔化 NaHCO3===Na++HCO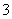
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是 ( )
A.0.1 mol·L-1 NaOH溶液:K+、Na+、SO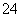 、CO
、CO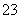
B.0.1 mol·L-1 Na2CO3溶液:K+、Ba2+、NO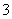 、Cl-
、Cl-
C.0.1 mol·L-1 FeCl3溶液:K+、NH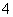 、I-、SCN-
、I-、SCN-
D.c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、NO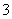
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是 ( )
A.向水中通入氯气:Cl2+H2O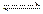 2H++Cl-+ClO-
2H++Cl-+ClO-
B.向氯化铁溶液中加入铜:2Fe3++3Cu===2Fe+3Cu2+
C.NH4HCO3溶液与过量KOH浓溶液共热:NH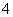 +OH-
+OH-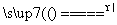 NH3↑+H2O
NH3↑+H2O
D.向二氧化锰中滴加浓盐酸并加热:MnO2+4H++2Cl-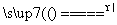 Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
| 阳离子 | Na+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl |
分别取四种物质进行实验,实验结果如下①B溶液分别与C、D混合,均有白色沉淀生成②将A溶液逐滴滴入C溶液中,有沉淀生成,继续滴加A溶液时,沉淀减少直至完全消失③A与D两种固体混合有气体生成,该气体能使湿润的红色石蕊试液变蓝④用石墨电极电解B溶液,在阳极上产生一种有刺激性气味的气体
回答下列问题:
(1)A所含的阳离子和C所含阳离子的半径大小_▲___>___▲___(填离子符号)。B所含的阴离子是____▲____
(2)C溶液呈__▲_性(填“酸性”或“碱性”),其原因是______▲____________
(用离子方程式解释)。D的化学式是_____▲_______
(3)以Pt为电极电解1L0.1mol/LB的水溶液,当电路中通过0.1mol电子时,
溶液的pH为___▲____(设电解过程溶液体积不变),阳极的电极反应式为 ___▲__
(4)若将④阳极产生的气体通入A溶液中至恰好完全反应时,则溶液中各离子
浓度由大到小的排列顺序为____________▲______________
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应既是离子反应,又是氧化还原反应的是( )
A.BaCl2溶液中滴加稀H2SO4
B.盐酸和氧化铁反应
C.铁片放入CuSO4溶液中
D.氢气还原CuO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com