
| A. | 58.5 g氯化钠中约含有6.02×1023个氯化钠分子 | |
| B. | 常温常压下,2.24LC2H4中含有共用电子对的数目为0.6NA | |
| C. | 0.1molNa2O2与足量的水反应,转移电子数为0.2NA | |
| D. | 200mL 0.5 mol•L-1的Na2CO3溶液中CO32-离子数目小于0.1 NA |
分析 A、依据通常情况下,氯化钠是离子化合物,无分子存在分析判断;
B、依据气体摩尔体积的条件应用分析判断;
C、依据过氧化钠与水反应是过氧化钠自身的氧化还原反应计算电子转移数;
D、依据碳酸根离子水溶液中水解分析判断;
解答 解:A、通常条件下,氯化钠是离子化合物,由阴阳离子构成无分子存在,故A错误;
B、常温常压下,2.24LC2H4物质的量不是0.1mol,所以含有共用电子对的数目不是0.6NA;故B错误;
C、Na2O2与足量的水反应生成氢氧化钠和氧气,化学方程式为2Na2O2+2H2O=4NaOH+O2,每2molNa2O2反应转移电子物质的量为2mol,所以0.1mol过氧化钠反应电子转移为0.1mol,故C错误;
D、200mL0.5mol•L-1的Na2CO3溶液中碳酸钙离子物质的量为0.1mol,但由于碳酸根离子水解,所以含碳酸根离子物质的量小于0.1NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的应用,主要考查离子化合物的结构,气体摩尔体积的条件应用,氧化还原反应的电子转移数计算,盐类水解的应用,题目难度不大.


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案科目:高中化学 来源: 题型:选择题
| A. | 7.8g Na2S和7.8g Na2O2中含有的阴离子数均为0.1NA | |
| B. | 0.1mol•L-1的NaHSO4溶液中含有阳离子物质的量为0.2mol | |
| C. | 常温常压下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24L | |
| D. | 1.8g ${\;}_{8}^{18}$O2分子与1.6g ${\;}_{8}^{16}$O2分子中含有的中子数均为0.8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:A>B>C>D | B. | 单质熔点:D>B,A>C | ||
| C. | 原子半径:C>B>D>A | D. | 简单离子半径:C>A>D>B |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,阴极质量增加6.4g,电路中电子转移的总数为0.2NA | |
| B. | 6.0gSiO2晶体中含有0.2NA个Si-O键 | |
| C. | 10g 46%乙醇溶液中含氧原子0.1NA | |
| D. | 苯与液溴反应生成1mol  时消耗0.5NA个Br2 时消耗0.5NA个Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
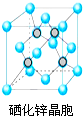 硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物.
硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com