
| 滴定次数 | 待测液体积 (mL) | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
| 难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
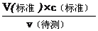
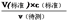 分析,可知c(待测)偏大,故C正确;D.碱式滴定管尖嘴部分有气泡,滴定后消失,造成V(标准)偏大,根据c(待测)=
分析,可知c(待测)偏大,故C正确;D.碱式滴定管尖嘴部分有气泡,滴定后消失,造成V(标准)偏大,根据c(待测)=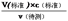 分析,可知c(标准)偏大,故D正确。(2)①因为KMnO4具有强氧化性,会腐蚀橡胶管,故应用酸式滴定管盛装;因KMnO4溶液自身的颜色作为指示剂判断滴定终点时,再滴加KMnO4溶液时,溶液将由无色变为紫色;②设草酸的浓度为c,
分析,可知c(标准)偏大,故D正确。(2)①因为KMnO4具有强氧化性,会腐蚀橡胶管,故应用酸式滴定管盛装;因KMnO4溶液自身的颜色作为指示剂判断滴定终点时,再滴加KMnO4溶液时,溶液将由无色变为紫色;②设草酸的浓度为c,

科目:高中化学 来源:不详 题型:单选题
| A.①②⑤ | B.①②③ | C.③④ | D.①②③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | I1 | I2 | I3 | I4 |
| 电离能(kJ/mol) | 578 | 1817 | 2745 | 11578 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.二氧化碳与超临界水作用生成汽油的反应,属于放热反应 |
| B.“水热反应”是一种复杂的物理化学变化 |
| C.火力发电厂可望利用废热,将二氧化碳转变为能源物质 |
| D.随着科技的进步,“水热反应”制取能源有望实现地球上碳资源的和谐循环 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2 | B.3 | C.12 | D.14 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.水电离出的c(H+):③>①>② |
| B.溶液的pH:③>②>① |
| C.①和②等体积混合后的溶液:c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-) |
| D.①和③等体积混合后的溶液:c(Na+)+ c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题


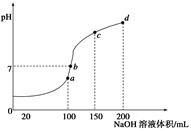
| A.图2是滴定盐酸的曲线 |
| B.a与b的关系是:a<b |
| C.E点对应离子浓度由大到小的顺序为: c(CH3COO-)> c(Na+)> c(H+)> c(OH-) |
| D.这两次滴定都可以用甲基橙作为指示剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com