
【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃,可用于处理部分含硫废水。某小组在实验室中利用下列装置制备ClO2(此制备方法中经空气稀释的SO2与ClO2不反应)。
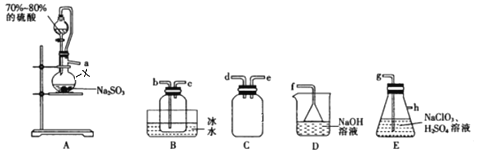
回答下列问题:
(1)仪器X的名称是__________________________。
(2)欲选择上图中的装置收集ClO2,其连接顺序为a→______(按气流方向,用小写字母表示)。
(3)装置C的作用是_________,装置E中反应的离子方程式为__________________________________。
(4)处理含硫(Na2S)碱性废水时,ClO2与Na2S反应(S2-被氧化为SO42-)的离子方程式为_________________;处理含硫碱性废水时,相同条件下同体积的ClO2相对于Cl2的优点是______________________________。
(5)ClO2很不稳定,需现用现配,为测定所得溶液中ClO2的含量,进行下列实验:
步骤1:准确量取V1 mL ClO2溶液加入锥形瓶中。
步骤2:用稀硫酸调节ClO2溶液的pH≤2.0,再加入足量KI晶体,静置片刻。
步骤3:加入指示剂,用c mol·L-1的Na2S2O3标准溶液滴定至终点时,消耗V2 mL Na2S2O3标准溶液。
(已知:2ClO2+8H++10I-===2C1-+5I2+4H2O;2S2O32-+I2===2I-+S4O62-)原溶液中ClO2的含量为____________(用含c、V1、V2的代数式表示)g·L-1。
【答案】蒸馏烧瓶 d-e-g-h-b-c-f 防倒吸 SO2+2ClO3-=2ClO2+SO42- 8ClO2-+5S2-+8OH-=8Cl-+5SO42-+4 H2O ClO2得电子数是Cl2的2.5倍,除硫酸率高 ![]()
【解析】
(1)根据仪器结构和性能确定仪器X的名称;
(2)ClO2 的制备:装置A中又Cu与浓硫酸发生反应制备SO2气体,在装置E中反应生成二氧化氯,为防止倒吸,A与E之间连接装置C,二氧化氯沸点较低,故在B中冰水浴收集,最后用氢氧化钠吸收未反应完的二氧化硫,防止污染空气,据此分析解答;
(3)SO2气体在装置E中反应生成二氧化氯较快,为防止倒吸,在A与E之间连接装置C,SO2和KClO3反应时,KClO3被还原生成ClO2,则SO2被氧化生成SO42-,结合电子守恒、电荷守恒写出反应的离子方程式;
(4)根据实验可知ClO2 与 Na2S 反应有氯离子、硫酸根离子的生成;根据ClO2和Cl2除硫效果分析;
(5)由2ClO2+8H++10I-═2Cl-+5I2+4H2O、2S2O32-+I2═2I-+S4O62-得到关系式为ClO2~5S2O32-,有n(ClO2)=![]() n(S2O32-)。
n(S2O32-)。
(1)仪器X的名称是蒸馏烧瓶;
(2)二氧化硫从a进入装置E中反应,为防止倒吸,应在E之前有安全瓶,则a→d→e,为反应充分,故连接E装置中的g,二氧化氯沸点较低,故在B中冰水浴收集,为充分冷却,便于收集,应连接b,最后用氢氧化钠吸收未反应完的二氧化硫,防止污染空气,连接顺序为:d→e→g→h→b→c→f ;
(3)SO2气体在装置E中反应生成二氧化氯较快,在A与E之间连接装置C为防止倒吸,SO2还原KClO3生成ClO2,则SO2被氧化生成SO42-,反应的离子方程式为
SO2+2ClO3-=2ClO2+SO42-;
(4)由上述分析可知ClO2 与 Na2S 反应有氯离子、硫酸根离子的生成,所以反应的离子方程式为:8ClO2+5S2-+4H2O=8Cl-+5SO42-+8H+;ClO2除硫效果彻底,氧化产物硫酸根更稳定、ClO2在水中的溶解度大、剩余的ClO2不会产生二次污染、相同质量的ClO2、Cl2均被还原为氯离子时,ClO2得到的电子数是氯气的2.5倍等;
(5)由2ClO2+8H++10I-═2Cl-+5I2+4H2O、2S2O32-+I2═2I-+S4O62-得到关系式为ClO2~5S2O32-,所以n(ClO2)=![]() n(S2O32-)=
n(S2O32-)=![]() ×V2×10-3×cmol=2cV2×10-4mol,m(ClO2)=nM=2cV2×10-4mol×67.5g/mol=1.35cV2×10-2g,原溶液中ClO2的含量=
×V2×10-3×cmol=2cV2×10-4mol,m(ClO2)=nM=2cV2×10-4mol×67.5g/mol=1.35cV2×10-2g,原溶液中ClO2的含量=![]() =
=![]() g/L。
g/L。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】现有①0.2mol/LNaOH溶液和②0.2mol/L HX溶液,两溶液等体积混合后,测得溶液中c(Na+)>c(X—)。则:
(1)①中由水电离出的c(OH)-___②中由水电离出的c(H+)。(填“>”、“=”或“<”)
(2)上述混合液中共存在___种粒子。且:c(HX)___c(X-)。(填“>”、“=”或“<”,下同)c(HX)+c(X-)___0.1mol/L(忽略体积变化)
请根据电荷守恒写出一个用离子浓度表示的等式:___。
(3)上述混合液显___性(填“酸”、“碱”或“中”),其原因用离子方程式表示___。
(4)已知t℃,KW=1×10-13,则t℃(填“>”或“<”或“=”)___25℃。在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与对应的方程式不符合的是
A. 硫化氢溶液呈酸性:H2S ![]() 2H++S2–
2H++S2–
B. “NO2球”浸泡在冷水中,颜色变浅:2NO2(g) (红棕色) ![]() N2O4 (g) (无色) ΔH<0
N2O4 (g) (无色) ΔH<0
C. 甲烷的燃烧热ΔH=–890.3 kJ·mol–1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=–890.3 kJ·mol–1
D. 硫代硫酸钠溶液与稀硫酸混合出现浑浊:S2O32–+2H+=S +SO2 +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钠是一种基础化工原料。
(1)已知:Cl2(g)+2OH-(aq)=ClO-(aq)+Cl-(aq)+H2O(l) ΔH=-186 kJ·mol-1,3ClO-(aq)=ClO3— (aq)+2Cl-(aq) ΔH=-113 kJ·mol-1,则:3Cl2(g)+6OH-(aq)=ClO3—(aq)+5Cl-(aq)+3H2O(l)ΔH=____kJ·mol-1,该反应中生成1molClO3—,转移电子数为____。
(2)工业上采用无隔膜电解饱和食盐水可制备氯酸钠。该工艺过程中,生成氯酸钠的相关反应为:Cl2+H2O![]() H++Cl-+HClO,HClO
H++Cl-+HClO,HClO![]() H++ClO-,2HClO+ClO-=ClO
H++ClO-,2HClO+ClO-=ClO![]() +2H++2Cl-。已知:溶液中,Cl2、HClO、ClO-的物种分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图。
+2H++2Cl-。已知:溶液中,Cl2、HClO、ClO-的物种分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图。

①电解过程中,为按化学计量数比反应,需控制电解液的pH约为___(填序号)。
A.5 B.6.8 C.7.2D.7.5
②若电解液碱度过大,阳极会有较多的O2放出,电极反应方程式为____。已知:Cr2O72—+H2O![]() 2CrO42—+2H+,电解时向食盐水中加入的重铬酸钠(Na2Cr2O7)可以防止电解液碱度过大,其原理是____。
2CrO42—+2H+,电解时向食盐水中加入的重铬酸钠(Na2Cr2O7)可以防止电解液碱度过大,其原理是____。
③若电解液pH<5时,溶液中HClO浓度会随pH减小迅速降低,其原因是____(用离子方程式表示)。
(3)电解时须对电解槽进行冷却处理以防止电解液温度过高的原因是____。
(4)氯酸钠与硫酸酸化的双氧水溶液反应常用于制备饮用水消毒剂ClO2(g),该反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol有机物X最多能与1 mol HCl发生加成反应得到Y,1 mol Y能与4 mol Cl2在一定条件下发生取代反应得到Z。已知Y分子中的碳碳键都是单键,Z分子中没有氢原子,则X的结构简式可能是( )
A.![]() B.CH≡CH
B.CH≡CH
C.![]() D.CH≡CCH3
D.CH≡CCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列5种有机物:
① HCOOCH3 ② CH3COOH ③ CH3—CH=CH2 ④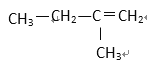 ⑤
⑤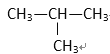
(1) 其中符合通式CnH2n+2的是________ ( 填序号,下同 ), 与 ①互为同分异构体的是_________,与 ③ 互为同系物的是___________
(2) 用系统命名法给 ⑤ 命名,其名称为 _________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的制备,符合工业生产实际的是![]()
A.工业上炼铁时,常用石灰石除去铁矿石中的![]()
B.工业上用接触法制硫酸,在接触室里制出硫酸
C.工业上用二氧化硅在高温下与焦炭反应制得高纯度的硅
D.工业上主要从海水中提取碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度相同、浓度相同的条件下,下列六种物质的水溶液的pH由小到大的排列顺序如图所示。
![]()
图中①、②、③可能是( )
A.NH4NO3、(NH4)2SO4、CH3COONa
B.(NH4)2SO4、NH4Cl、C6H5ONa
C.(NH4)2SO4、NH4NO3、Na2CO3
D.(NH4)2SO4、NH4NO3、CH3COONa
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com