
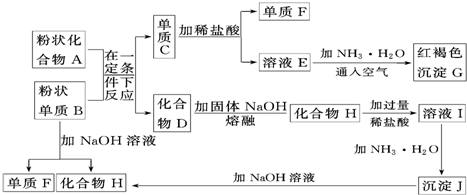
分析 G是红棕色沉淀,则G是Fe(OH)3,E和氨水、空气反应生成氢氧化铁,则E中含有亚铁离子,则单质C为Fe,铁和盐酸反应生成亚铁盐和氢气,所以F是H2,E为FeCl2,粉末状单质B能和强碱溶液反应生成氢气和溶液K,两种固体在一定条件下反应生成铁,且B为单质,说明二者发生铝热反应,则B是Al,D为Al2O3,A为铁的氧化物,H为偏铝酸盐,氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,所以H为NaAlO2,H溶于水生成偏铝酸钠溶液,偏铝酸钠和过量酸反应生成铝盐,所以I中含有氯化铝、氯化钠以及过量的盐酸,铝盐和氨水反应生成Al(OH)3,所以J是Al(OH)3,再结合题目解答.
解答 解:G是红棕色沉淀,则G是Fe(OH)3,E和氨水、空气反应生成氢氧化铁,则E中含有亚铁离子,则单质C为Fe,铁和盐酸反应生成亚铁盐和氢气,所以F是H2,E为FeCl2,粉末状单质B能和强碱溶液反应生成氢气和溶液K,两种固体在一定条件下反应生成铁,且B为单质,说明二者发生铝热反应,则B是Al,D为Al2O3,A为铁的氧化物,H为偏铝酸盐,氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,所以H为NaAlO2,H溶于水生成偏铝酸钠溶液,偏铝酸钠和过量酸反应生成铝盐,所以I中含有氯化铝、氯化钠以及过量的盐酸,铝盐和氨水反应生成Al(OH)3,所以J是Al(OH)3,
(1)根据上面的分析可知,C为Fe,H为NaAlO2,
故答案为:Fe;NaAlO2;
(2)E为FeCl2,由E生成G的离子反应方程式为2Fe2++Cl2=2Fe3++2Cl-、Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,
故答案为:2Fe2++Cl2=2Fe3++2Cl-、Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+;
(3)根据上面的分析可知,I中含有氯化铝、氯化钠以及过量的盐酸,所以溶液I中所含金属离子是H+、Al3+和Na+,
故答案为:H+、Al3+和Na+.
点评 本题考查元素化合物的特性和反应,用框图设问可以考查学生正向思维、逆向思维、发散和收敛思维,能根据题眼正确判断化合物是解本题的关键,难度中等.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | X所形成的单质都是双原子分子 | |
| B. | 原子半径X>Y | |
| C. | X、Y能形成的阴、阳离子数之比为1:2离子化合物,其一定为碱性氧化物 | |
| D. | 由X、Y组成的某化合物与水反应能生成一种强碱和一种弱碱,其简单离子半径:X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
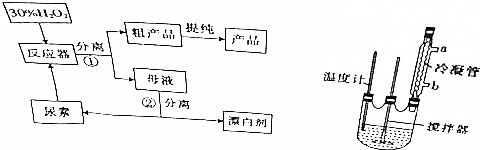
| 分子式 | 外观 | 热分解温度 | 熔点 |
| CO(NH2)2•H2O2 | 白色晶体 | 45℃ | 75~85℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.9mol/L | D. | 1.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).
工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8gNa2O2与CO2反应,转移的电子数为0.2NA | |
| B. | 1mol/L的CaCl2溶液中含Cl-的数目为2 NA | |
| C. | 常温常压下,17g NH3含氢原子数目为3NA | |
| D. | 1mol氢氧根离子中含有的电子数为9NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com