
| A. | BaCl2溶液与Na2S03溶液加足量稀HNO3 | |
| B. | Ba(0H)2溶液与KN03溶液加足量稀H2SO4 | |
| C. | AgN03溶液与Na2C03溶液加足量稀盐酸 | |
| D. | Ca(0H)2溶液与FeCl3溶液加足量稀HNO3 |
分析 A.BaCl2溶液与Na2S03溶液反应后生成亚硫酸钡沉淀,加足量稀HNO3,生成硫酸钡和一氧化氮气体;
B.Ba(OH)2溶液与KNO3溶液加足量稀H2SO4,氢氧化钡与硫酸发生复分解反应;
C.AgNO3溶液与Na2CO3溶液加足量稀HCl反应生成氯化银沉淀.
D.Ca(OH)2溶液与FeCl3溶液反应生成氢氧化铁,氢氧化铁与稀HNO3反应溶解.
解答 解:A.BaCl2溶液与Na2S03溶液反应后生成亚硫酸钡沉淀,加足量稀HNO3,生成硫酸钡和一氧化氮气体,会产生沉淀,故A错误;
B.Ba(OH)2溶液与KNO3溶液加足量稀H2SO4,氢氧化钡与硫酸发生复分解反应生成硫酸钡沉淀和水,所以会产生沉淀,故B错误;
C.AgNO3溶液与Na2CO3溶液加足量稀HCl,硝酸银与盐酸反应生成氯化银沉淀,碳酸钠与盐酸反应生成氯化钠和水二氧化碳,所以会产生沉淀,故C错误;
D.Ca(OH)2溶液与FeCl3溶液反应生成氢氧化铁,氢氧化铁与稀HNO3反应生成硝酸铁和水,没有沉淀生成,故D正确;
故选:D.
点评 本题考查反应现象的判断,明确物质的性质和发生的化学反应是解题关键,题目难度不大.


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:多选题
| A. | 硫化亚铁溶于足量稀硝酸中:FeS+2H+═Fe2++H2S↑ | |
| B. | 石灰石溶于醋酸:CaCO3+2CH3COOH═2CH3COO-+Ca2++CO2↑+H2O | |
| C. | FeCl2溶液中通入少量氯气:Fe2++Cl2═Fe3++2Cl- | |
| D. | 硫酸亚铁溶液中滴加酸化的双氧水:2Fe2++2H++H2O2═2Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解过程中阴极和阳极的质量始终保持不变 | |
| B. | 溶液中的Cu2+、H+和Na+都要移向阴极,但在阴极优先放电的离子是Cu2+ | |
| C. | 溶液中的Cl-在阳极上完全放电后,溶液中的SO${\;}_{4}^{2-}$接着在该极上放电生成O2 | |
| D. | 电解过程中阴极上始终有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(NO2):V(O2)=2:1 | B. | V(NO):V(O2)=2:1 | ||
| C. | V(NH3):V(O2)=2:1 | D. | V(NO2):V(NO):V(O2)=1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高锰酸钾溶液与乙二酸(草酸)反应:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O | |
| B. | 在NH4HSO4溶液中慢慢滴入等物质的量的NaOH溶液:NH4++OH-═NH3•H2O | |
| C. | VO2+与酸性高锰酸钾溶液反应:5VO2++MnO4-+H2O═5VO2++Mn2++2H+ | |
| D. | AgNO3溶液中加入过量氨水:Ag++NH3•H2O═AgOH↓+NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 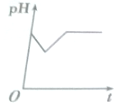 | B. | 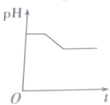 | C. | 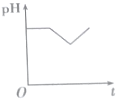 | D. | 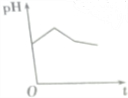 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
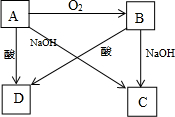
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Cu2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | B. | H+、K+、HCO${\;}_{3}^{-}$、Ca2+ | ||
| C. | Ba2+、Mg2+、OH-、Cl- | D. | Fe3+、NH${\;}_{4}^{+}$、S2-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
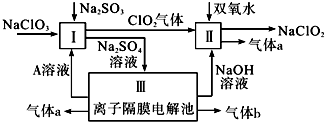
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com