
| A. | 当滴入20mL NaOH溶液时:2c(SO42-)=c(NH3•H2O)+c(NH4+) | |
| B. | 当滴入30mL NaOH溶液时(pH>7):c(NH4+)>c(NH3•H2O)>c(OH-)>c(H+) | |
| C. | 当溶液呈中性时:c(NH4+)>c(SO42-)>c(Na+)>c(H+)=c(OH-) | |
| D. | 整个反应过程中:c(H+)+c(Na+)+c(NH4+)=c(OH-)+2c(SO42-) |
分析 A.根据混合液中的电荷守恒判断;
B.滴入30mLNaOH溶液时,反应后的溶液中含有0.001mol一水合氨、0.0005mol硫酸铵,溶液的pH>7,说明一水合氨的电离程度大于铵根离子的水解程度;
C.根据混合液中的物料守恒判断;
D.当加入20mL氢氧化钠溶液时,二者反应生成硫酸铵、硫酸钠,由于铵根离子部分水解,溶液显示酸性,若为中性,则加入的氢氧化钠溶液稍大于20mL,据此进行判断.
解答 解:A.当滴入20mLNaOH溶液时,根据物料守恒可得:c(SO42-)=c(NH4+)+c(NH3•H2O),故A错误;
B.滴入30mLNaOH溶液时(pH>7),其中20mL氢氧化钠溶液与硫酸氢铵中的氢离子发生中和反应,属于的10mL氢氧化钠溶液与铵根离子反应,则反应后的溶液中含有0.001mol一水合氨、0.0005mol硫酸铵,溶液的pH>7,说明一水合氨的电离程度大于铵根离子的水解程度,则:c(NH4+)>c(NH3•H2O)、c(OH-)>c(H+),则溶液中离子浓度大小为:c(NH4+)>c(NH3•H2O)>c(OH-)>c(H+),故B正确;
C.根据物料守恒可得:c(SO42-)=c(NH4+)+c(NH3•H2O),则c(SO42-)>c(NH4+);由于溶液为中性,则c(H+)=c(OH-),根据电荷守恒可得:c(H+)+c(Na+ )+c(NH4+)=c(OH-)+2c(SO42-),所以c(Na+ )+c(NH4+)=2c(SO42-),结合c(SO42-)>c(NH4+)可知:c(Na+ )>c(SO42-),所以溶液中离子浓度大小为:c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-),故C错误;
D.溶液中一定满足电荷守恒:c(H+)+c(Na+ )+c(NH4+)=c(OH-)+2c(SO42-),故D正确;
故选BD.
点评 本题考查了离子浓度大小比较、酸碱混合的定性判断等知识,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒、盐的水解原理在判断离子浓度大小中的应用方法.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:选择题
| A. | 检验CH3CH2Cl碱性水解产生的Cl-,先要用稀硫酸酸化,再检验 | |
| B. | KMnO4溶液通常可用盐酸酸化,以增强氧化性 | |
| C. | 配置Fe(NO3)2溶液时,用硝酸酸化,可抑制水解 | |
| D. | 鉴别溶液中是否有SO42-,先用盐酸酸化,再加BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
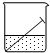
| A. | 铁钉与水面交接处最易腐蚀 | |
| B. | 铁钉发生吸氧腐蚀,铁做阴极 | |
| C. | 铁发生的反应是:Fe-3e→Fe3+ | |
| D. | 水上和水下部分的铁钉不发生电化腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将Al2(SO4)3溶液蒸干、灼烧至恒重,最终剩余固体是Al2O3 | |
| B. | 2mL10%的NaOH溶液中滴加2%的CuSO4溶液4~6滴制得新制氢氧化铜 | |
| C. | 将水蒸气通过灼热的铁粉,铁粉变红棕色,说明铁与水在高温下能发生反应 | |
| D. | 取a克Na2CO3和NaHCO3混合物与少量稀盐酸充分反应,加热、蒸干、灼烧至熔化,冷却得b克固体,可测得Na2CO3质量分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物:干冰、明矾、烧碱 | B. | 同素异形体:石墨、C60、金刚石 | ||
| C. | 非电解质:乙醇、四氯化碳、氯气 | D. | 混合物:漂白粉、纯净矿泉水、盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
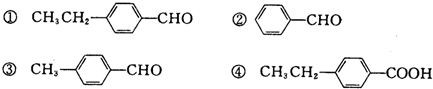
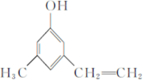 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,关于有机物M的叙述正确的是( )
,关于有机物M的叙述正确的是( )| A. | 有机物M的分子式为C11H14O3 | |
| B. | 1 molNa2CO3最多能消耗1 mol有机物M | |
| C. | 有机物M能发生取代、氧化、还原和加聚反应 | |
| D. | 有机物M能与热的新制氢氧化铜悬浊液反应,生成砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图所示.据图回答:
化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图所示.据图回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通常状况下,1mol/L Na2CO3溶液中含钠离子数为2NA | |
| B. | 4℃时,18g 2H216O中含有共用电子对数为2NA | |
| C. | 1mol N5+含有的电子数为34NA | |
| D. | 1mol NH4+中含有的中子数为10NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com