
【题目】硫代硫酸钠俗称“海波”,又名“大苏打”,溶液具有弱碱性和较强的还原性,是棉织物漂白后的脱氯剂,定量分析中的还原剂。硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图a所示。

已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图b所示,
(1)Na2S2O3·5H2O的制备:
步骤1:如图连接好装置后,检查A、C装置气密性的操作是____________________。
步骤2:加入药品,打开K1、关闭K2,加热。装置B、D中的药品可选用下列物质中的_________。(填编号)
A.NaOH溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.饱和NaHCO3溶液
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH在7—10时,打开K2、关闭K1并停止加热;C中溶液要控制pH的原因是____________。
步骤4:过滤C中的混合液,将滤液经过加热浓缩,趁热过滤,再将滤液__________、过滤、________、烘干,得到产品。
(2)Na2S2O3性质的检验:
向足量的新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,检验反应后溶液中含有硫酸根,写出该反应的化学方程式____________________________________________。
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解.此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010 mol·L-1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18.00 mL。部分反应的离子方程式为:Cr2O72-+6I-+14H+=3I2+2Cr3++3I2+7H2O I2+2S2O32-=S4O62-+2I-,则该废水中Ba2+的物质的量浓度为_______________。
【答案】 关闭K2打开K1,在D中加水淹没导管末端,用热毛巾或双手捂住烧瓶 ADC 硫代硫酸钠在酸性溶液中不稳定 冷却结晶 洗涤 Na2 S2O3+4Cl2+5H2O=Na2SO4+H2SO4+8HCl 0.0024mol/L
【解析】(1)步骤1:利用气体热胀冷缩性质,检验装置气密性;步骤2:装置B、D的作用是进行尾气处理,防止尾气中二氧化硫污染空气;步骤3:硫代硫酸钠在酸性溶液中不稳定,应控制溶液为弱碱性,即控制溶液pH接近或不小于7;步骤4:从溶液中获得晶体,需要加热浓缩,趁热过滤,再将滤液冷却结晶、过滤、洗涤、烘干,得到产品;根据溶解度曲线图可知趁热过滤的原因是防止硫代硫酸钠结晶析出;(2)由题目信息可知,Na2S2O3被氯水氧化反应生成Na2SO4、H2SO4,氯气被还原为HCl;(3)由题意可知,BaCrO4用盐酸溶解转化为Cr2O72-,由元素守恒及已知方程式可得关系式:2Ba2+~2BaCrO4~Cr2O72-~3I2~6Na2S2O3,结合消耗的Na2S2O3利用关系式计算溶液中n(Ba2+),进而计算c(Ba2+)。
(1)步骤1:利用气体热胀冷缩性质,检验装置气密性,具体操作为:故答案为:关闭K2打开K1,在D中加水淹没导管末端,用热毛巾或双手捂住烧瓶,D中导管有气泡冒出,冷却后形成1段水柱,说明气密性良好,步骤2:装置B、D的作用是进行尾气处理,防止尾气中二氧化硫污染空气,二氧化硫具有还原性,可以用酸性高锰酸钾溶液氧化吸收,二氧化硫能与氢氧化钠溶液、碳酸氢钠溶液反应被吸收,故选:ACD;步骤3:硫代硫酸钠在酸性溶液中不稳定,应控制溶液为弱碱性,可以控制溶液pH接近或不小于7,步骤4:从溶液中获得晶体,需要加热浓缩,趁热过滤,再将滤液冷却结晶、过滤、洗涤、烘干,得到产品,故答案为:关闭K2打开K1,在D中加水淹没导管末端,用热毛巾或双手捂住烧瓶;ACD;pH接近或不小于7;硫代硫酸钠在酸性溶液中不稳定;冷却结晶、洗涤;(2)由题目信息可知,Na2S2O3被氯水氧化反应生成Na2SO4、H2SO4,氯气被还原为HCl,反应方程式为:Na2 S2O3+4Cl2+5H2O=Na2SO4+H2SO4+8HCl;(3)由题意可知,BaCrO4用盐酸溶解转化为Cr2O2-7,由元素守恒及已知方程式可得关系式:2Ba2+~2BaCrO4~Cr2O72-~3I2~6Na2S2O3,消耗的Na2S2O3为0.018L×0.01mol/L,则n(Ba2+)=0.018L×0.01mol/L×![]() =0.00006mol,故溶液中c(Ba2+)=
=0.00006mol,故溶液中c(Ba2+)=![]() =0.0024mol/L。
=0.0024mol/L。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】下列溶液中粒子的物质的量浓度关系正确的是( )
A. 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO![]() )>c(HCO
)>c(HCO![]() )>c(OH-)
)>c(OH-)
B. 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH)
C. 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH![]() )+c(OH-)
)+c(OH-)
D. 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若测得盐酸和氢氧化钠溶液反应生成18g水时放出的热量为Q,则下列各反应在溶液中生成18g水时,放出的热量也为Q的是
①醋酸和氢氧化钠溶液; ②氨水和盐酸 ③氢氧化钾溶液和硝酸
A.①②③B.①③C.②③D.③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.100mol·L-1的HA溶液,溶液的pH与所加NaOH溶液体积(V)的关系如图所示。下列说法不正确的是
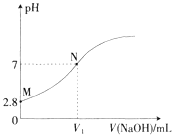
A. V1<20
B. Ka(HA)的数量级为10-5
C. M点溶液加少量水稀释,![]() 增大
增大
D. N点后,随着NaOH溶液的加入,溶液中水的电离程度逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 kJ。该反应的热化学方程式为__________________________。
(2)反应AX3(g)+X2(g)![]() AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
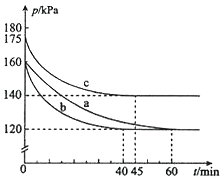
①实验a从反应开始至达到平衡时的反应速率v(AX5)=________(保留两位有效数字)。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为___________ (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:
b____________________、c____________________。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一端封闭的U形管,封闭的一端有一段CH4和Cl2的混合气体,在水平部分有一段气柱,其他两段为液柱,已知液体与气体不反应.使CH4和Cl2在稍暗的光线下缓慢反应,则中间气柱的长度将(假设中间气柱未移出U形管水平部分)( )

A. 变大B. 变小C. 不变D. 难以确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应式为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,原电池负极的电极反应式为 ______;放电时正极附近溶液的碱性____(填“增强”。“不变“或“减弱”)。
3Zn(OH)2+2Fe(OH)3+4KOH,原电池负极的电极反应式为 ______;放电时正极附近溶液的碱性____(填“增强”。“不变“或“减弱”)。
(2)三元锂电池是以镍钴锰为正极材料的新型电池,镍钴锰材料可表示为Li1-nNixCoyMnzO2,x+y+z=1,通常简写为Li1-nMO2,Ni、Co、Mn三种元素分别显+2、+3、+4价。其充电时总反应为:LiMO2+C6![]() Li1-nMO2+LinC6。
Li1-nMO2+LinC6。

①充放电电时,电解液的主要作用________________________________________。
②在Li1-nMO2材料中,若x︰y︰z=2︰3︰5,则n=______________。
③放电时,正极反应为:__________________________。
④充电时,当转移0.2amol电子,负极材料减重_____________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又是吸热反应的是:
A.铝片与稀盐酸反应B.Ba(OH)2·8H2O与NH4Cl反应
C.灼热的碳与CO反应D.甲烷在氧气中燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是
A. FeBr2溶液中加入等物质的量的Cl2:2Fe2+ + 2Br- + 2Cl2 = 2Fe3++Br2+4Cl-
B. 用氢氟酸在玻璃上“刻字”:SiO2 + 4H+ + 4F- = SiF4↑+ 2H2O
C. 将铜丝投入稀硝酸中:Cu + 4H+ + 2NO3-= Cu2+ + 2NO2↑+ 2H2O
D. NaOH与NH4Cl溶液混合加热:NH4+ + OH- ![]() NH3·H2O
NH3·H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com