
【题目】T℃下,三种硫酸盐MSO4 (M: Pb2+、Ba2+、Sr2+)的沉淀溶解平衡曲线如图所示。已知pM=-lgc(M),p(SO42-)=-lgc(SO42-)。下列说法正确的是
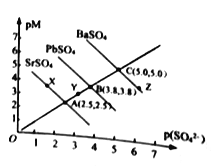
A. 溶度积:BaSO4>PbSO4>SrSO4
B. Y 点对SrSO4是不饱和溶液,能继续溶解SrSO4
C. Z点对应的溶液中c(Ba2+)42-),二者的浓度积等于1×10-10
D. BaSO4不 可能转化成PbSO4
科目:高中化学 来源: 题型:
【题目】有机物A、B、C、D、E、F之间有如下的转化关系:
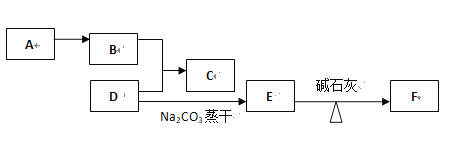
已知F是结构最简单的烃,C是具有水果香味的液体、不溶于水,分子中有4个碳原子;A是重要的化工原料,是衡量国家石油化工发展水平的标志。试写出:
(1)F的结构式________ ,它与氯气发生反应的产物是_________(填纯净物或混合物)
(2) B+D→C的化学方程式___________________________________;
(3)A→B的化学方程式________________反应类型_____________;
(4)以乙炔为原料制聚氯乙烯:
步骤一:化学方程式 _________________反应类型_____________;
步骤二:化学方程式 _________________反应类型_____________;
(5)戊烷是F的同系物,写出戊烷的所有同分异构体______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向淀粉溶液中加入少量稀H2SO4,加热使淀粉发生了水解反应,为测定其水解程度,所需的试剂是
①银氨溶液 ②新制Cu(OH)2悬浊液 ③NaOH溶液 ④碘水 ⑤BaCl2
A. ①⑤ B. ②④ C. ①②④ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有HA、HB和H2C三种酸。室温下用0.1mol·L-1NaOH溶液分别滴定20.00 mL浓度均为0.1mol·L-1的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH 溶液体积的变化如图所示。
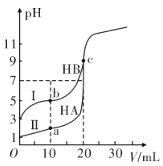
(1)a点时的溶液中由水电离出的c(H+)=________mol·L-1,Ka(HB)=________。
(2)与曲线I 上的c点对应的溶液中各离子浓度由大到小的顺序为________;b点对应的溶液中c(HB)____c(B-)(填“>”“<”或“=”)。
(3)已知常温下向0.1mol·L-1的NaHC 溶液中滴入几滴石蕊试液后溶液变成红色。
①若测得此溶液的pH=1,则NaHC的电离方程式为_______________。
②若在此溶液中能检测到H2C 分子,则此溶液中c(C2-)________c(H2C)(填“>”“<”或“=”)。
③若H2C的一级电离为H2C=H++ HC-,常温下0.1mol·L-1H2C溶液中的c(H+ )=0.11mol·L-1,则0.1mol·L-1NaHC溶液中的c(H+)________0.01mol·L-1(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米氧化锌是一种多功能性的新型无机材料,在橡胶、玻璃、涂料等各个领域广泛的应用。工业由粗氧化锌(含少量FeO、CuO 等杂质) 制备活性氧化锌的工业流程如下:

已知:Fe3+、Fe2+、Cu2+完全沉淀的pH分别是:3.2,8.1,6.7
(1)“酸浸”时用的硫酸溶液的密度为1.4g/mL,质量分数为70%,则该硫酸的物质的量浓度为____。
(2)焙烧前粉碎的目的是____________________________________________。
(3)滤液中加锌粉的目的是_____________________________________。
(4)物质A的主要成分_______________(填化学式),检验A中阳离子的方法是_______________。
(5)滤液中加H2O2发生反应的离子方程式__________________________。
(6)6.82g碱式碳酸锌[aZn(OH)2·bZnCO3·cH2O]恰好溶解在40mL3mol/LHCl中,同时产生448mLCO2(标准状况下),试推算碱式碳酸锌的化学式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 用石墨电极电解MgCl2溶液:Mg2++ 2C1- + 2H2O![]() Mg(OH)2↓+ Cl2↑+ H2↑
Mg(OH)2↓+ Cl2↑+ H2↑
B. 向碳酸氢铵溶液中加入足量石灰水: Ca2++ HCO3- + OH–![]() CaCO3↓+H2O
CaCO3↓+H2O
C. 向氢氧化钡溶液中加入硫酸氢钠至溶液为中性: Ba2++OH– + H+ + SO42-![]() BaSO4↓+H2O
BaSO4↓+H2O
D. 向Fe(NO3)3溶液中加入过量的HI溶液:2NO3-+8H++6I- == 3I2+2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请写出泡沫灭火器(硫酸铝和碳酸氢钠溶液) 灭火时发生反应的离子方程式:_______________。
(2)常温下若溶液由pH=3的HA溶液V1mL 与pH=11的NaOH溶液V2mL混合而得正确的有_______________。
A.若混合后溶液呈中性:c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,混合后溶液pH一定等于7
C.若混合后溶液呈酸性,则V1一定大于V2
D.若混合后溶液呈碱性,则V1一定小于V2
(3)常温下,浓度均为0.1mol/L的下列五种溶液的pH如表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①根据表中数据,将浓度均为0.01mo/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是_________。
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是_________。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+H2O+CO2↑
(4)某温度时,测得0.01mol·L-1 的NaOH溶液的pH为10。若将此温度下pH=10的NaOH 溶液aL与pH=1的稀硫酸bL混合,(设混合后溶液体积的微小变化忽略不计),若所得混合液pH=2,则a:b=_______。
(5)25℃,用0.1000 mol/LNaOH 溶液滴定20.00mL0.1000mol/L 某一元酸HA溶液所得滴定曲线如图。

①为减小实验误差,滴定时应选用适当的指示剂,判断该滴定终点的现象为(必须描述颜色的变化)______________________。
②A、B、C三点所示溶液导电能力最强的是___________点对应的溶液;
③比较A、C两点中水的电离程度:A_______C (填“>”、“ =”或“<”)。
(6)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为______________________。
(7)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净CuCl2溶液,宜加入__________调至溶液pH=4,使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_________mol/L。[Fe(OH)3的Ksp=2.6×10-39]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com