
| 滴定次数 | 待测液体积/mL | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 4.20 | 26.70 |
分析 (1)碱式滴定管用来盛装碱性溶液,酸式滴定管用来盛放酸性、氧化性溶液;
(2)滴定过程中眼睛应盯住锥形瓶中颜色变化;氢氧化钠溶液中加入酚酞变红,滴入盐酸后,溶液碱性减弱,颜色逐渐变浅,到变为无色且半分钟不恢复颜色即达到终点;
(3)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(4)先根据数据分析舍去误差太大的数据,再据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$计算出c(待测);
(5)据c(待测)结合m=cVM计算250mL烧碱样品中氢氧化钠的质量,依据ω=$\frac{氢氧化钠质量}{样品质量}$×100%,计算纯度;
解答 解:(1)烧碱即氢氧化钠显碱性,应用碱式滴定管量取;
故答案为:碱式滴定管;
(2)滴定过程中眼睛应盯住锥形瓶中颜色变化;氢氧化钠溶液中加入酚酞变红,滴入盐酸后,溶液碱性减弱,颜色逐渐变浅,到变为无色且半分钟不恢复颜色即达到终点;
故答案为:锥形瓶中颜色变化;溶液颜色由红色变为无色,且半分钟保持不变;
(3)A.滴定前酸式滴定管下端无气泡,滴定后酸式滴定管下端出现气泡,导致读取体积偏小,溶液浓度偏低,故A选;
B.酸式滴定管用蒸馏水洗涤后,直接装盐酸,导致标准液被稀释,浓度降低,消耗的标准液体积偏大,溶液浓度偏高,故B不选;
C.滴定时,反应容器摇动太激烈,有少量液体溅出,导致消耗的标准液体积偏小,溶液浓度偏低,故C选;
D.滴定到终点时,滴定管尖嘴悬有液滴,导致消耗的标准液体积偏大,溶液浓度偏高,故D不选;
故选:AC;
(4)第3次实验误差太大,V(标准)=[(20.40-0.50)+(24.10-4.00)]mL÷2=20.00mL,
c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$=$\frac{0.2000mol/L×20.00mL}{10.00mL}$=0.4000mol•L-1,
故答案为:0.4000mol•L-1;
(5)则m=cVM=0.4000mol•L-1×0.25L×40g/mol=4.00g,ω(NaOH)=$\frac{4.00g}{5.0g}$×100%=80%,
故答案为:80%.
点评 本题主要考查了中和滴定操作的基本步骤及烧碱的纯度的计算,难度中等,明确中和滴定实验的原理是解题关键,注意误差分析的方法.


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:选择题
| A. | 假说经过反复验证和修正,才发展成为科学的理论 | |
| B. | 研究物质的性质常用观察、实验、分类、比较等方法 | |
| C. | 在研究原子结构的过程中建立起的各种模型属于思维模型 | |
| D. | 依据丁达尔现象可将分散系分为溶液、胶体与浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
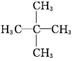 2,2-二甲基丙烷,写出它和氯气发生一取代反应的方程式
2,2-二甲基丙烷,写出它和氯气发生一取代反应的方程式 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$ +HCl
+HCl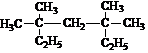 3,3,5,5-四甲基庚烷;它的一氯代物具有不同沸点的产物有4种
3,3,5,5-四甲基庚烷;它的一氯代物具有不同沸点的产物有4种 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
| 1 | 20.00 | 18.80 |
| 2 | 20.00 | 16.95 |
| 3 | 20.00 | 17.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

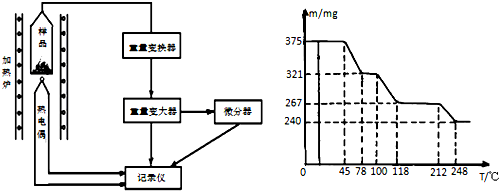
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量Na2CO3固体,平衡①右移,平衡②左移,溶液中c(F-)增大 | |
| B. | 加入少量NaOH固体至c(F-)>c(HF),溶液一定呈碱性 | |
| C. | 加入少量Na至pH=8,则C(Na+)-c(F-)=0.99×10-7mol•L-1 | |
| D. | 加入少量盐酸,$\frac{c({F}^{-})}{c(HF)•c(O{H}^{-})}$不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com