
| A、①②③ | B、②⑤⑥ |
| C、①③④ | D、全部 |
 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
| A、观察容量瓶刻度线时仰视 |
| B、小烧杯,玻璃棒没有洗涤 |
| C、所用容量瓶中已有少量水 |
| D、观察容量瓶刻度线时俯视 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硅是一种亲氧元素,在自然界中大多以氧化物和硅酸盐的形式存在 |
| B、硅在地壳中的含量居第一位 |
| C、利用硅的半导体性能,可以制作光电池 |
| D、硅晶体的结构与金刚石类似 |
查看答案和解析>>
科目:高中化学 来源: 题型:
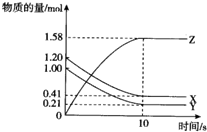 一定温度下,在10L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在10L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )| A、反应进行到10s时已达到了平衡状态 |
| B、反应开始10s时,X的物质的量浓度减少了0.79mol?L-1 |
| C、反应开始到10s时,已用去的Y占起始量的百分比为21% |
| D、反应的化学方程式为:2X(g)+2Y(g)═3Z(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、凡含有食品添加剂的食物对人体健康均有害,不可食用 |
| B、提倡人们购物时不用塑料袋,是为了防止白色污染 |
| C、防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |
| D、利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al-Al2O3-Al(OH)3-NaAlO2 |
| B、Fe-FeCl3-Fe(OH)2-Fe(OH)3 |
| C、S-SO3-H2SO4-MgSO4 |
| D、N2-NO-NO2-HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
37 17 |
23 11 |
| 元素代号 | W | R | X | Y | Z |
| 原子半径/nm | 0.037 | 0.157 | 0.066 | 0.070 | 0.077 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2,+4 |
| 化学键 | H-H | N≡N | H-N |
| 生成(或断裂)1mol化学键时放出(或吸收)的能量 | 436kJ | 946kJ | 390kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com