
某锂电池的电池总反应为4Li+2SOCl2=4LiCl+S+SO2,下列有关说法正确的是( )
A.锂电极作电池负极,放电过程中发生还原反应
B.1 mol SOCl2发生电极反应转移的电子数为4 mol
C.电池的正极反应为2SOCl2+2e-=4Cl-+S+SO2
D.组装该电池必须在无水、无氧的条件下进行
科目:高中化学 来源:2013-2014陕西省岐山县第二学期高二期末化学试卷(解析版) 题型:填空题
(10分)乙二酸-1,4-环己二醇酯可以通过下列路线合成。请回答下列问题:

(1)上述反应①—④中,属于取代反应的有 (填序号);反应⑥—⑧中,属于加成反应的有 (填序号)。
(2)写出下列物质的结构简式:B ,C 。
(3)写出下列反应的方程式:
反应②: ; 反应⑦: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014陕西省富平县高二下学期期末考试化学试卷(解析版) 题型:填空题
为测定某有机化合物A的结构,进行如下实验:
(一)分子式的确定:
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4 g H2O和8.8 g CO2,消耗氧气6.72 L(标准状况下),则该物质中各元素的原子个数比是________。
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图1所示质谱图,则其相对分子质量为________,该物质的分子式是________。
(3)根据价键理论,预测A的可能结构并写出结构简式______________________。
(二)结构式的确定:
(4)核磁共振氢谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如:甲基氯甲基醚(Cl—CH2—O—CH3)有两种氢原子如图2。经测定,有机物A的核磁共振氢谱示意图如图3,则A的结构简式为________。
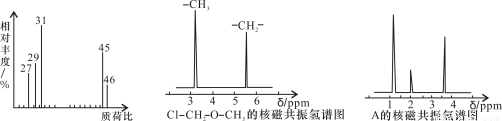
图1图2图3
查看答案和解析>>
科目:高中化学 来源:2013-2014陕西省富平县高二下学期期末考试化学试卷(解析版) 题型:选择题
以下烷烃中,一氯代物只有一种的是 ( )
A.乙烷 B.丙烷 C.2-甲基丁烷 D.2,2-二甲基丁烷
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市下学期期中考试高二化学试卷(解析版) 题型:填空题
(10分)Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,Q、W、Z是非金属元素。五种元素核电荷数之和为55,对应原子最外层电子数之和为21。W、Z最外层电子数相同,但Z的核电荷数是W的2倍。
(1)Q在周期表中位于第 周期 族。
(2)X、Y各自的最高价氧化物对应的水化物可以发生反应生成盐和水,请写出该反应的离子方程式: 。
(3)X单质能在W单质中燃烧可生成化合物R,R的电子式 ___,该物质所含有的化学键的类型为 。
(4)Z的氢化物与W的氢化物发生反应生成Z单质和水,写出其化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市下学期期中考试高二化学试卷(解析版) 题型:选择题
已知反应4CO+2NO2 N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
A.v(CO)=1.5 mol·L-1·min-1 B.v(NO2)=0.7 mol·L-1·min-1
C.v(N2)=0.4 mol·L-1·min-1 D.v(CO2)=1.1 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市下学期期中考试高二化学试卷(解析版) 题型:选择题
下列有关原电池的说法中,正确的是( )
A.铝片和镁片用导线连接后插入NaOH溶液中,镁片较活泼,作负极
B.铝片和铜片用导线连接后插入浓硝酸中,铜作负极
C.镀锌铁和镀锡铁的镀层破损后,前者较易被腐蚀
D.将反应2Fe3++Fe=3Fe2+设计为原电池,则可用锌片作负极,铁片作正极,FeCl3溶液作电解质
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市下学期期中考试高一化学试卷(解析版) 题型:选择题
中学化学中很多“规律”都可以类推,下列根据有关“规律”推出的结论正确的是( )
A.CO2为直线形分子,故CS2也为直线形分子
B.浓硫酸可以干燥HCl气体,故也可用浓硫酸干燥HI气体
C.Na在空气中燃烧会生成Na2O2,故Li在空气中燃烧也会生成Li2O2
D.卤族元素单质随核电荷数增加熔点升高,故碱金属单质熔点也随核电荷数增加而升高
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市高三5月月考理综化学试卷(解析版) 题型:实验题
(12分)为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)实验过程如下:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中的溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2ml的溶液流入D试管中,检验其中的离子.
V.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3.
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子.
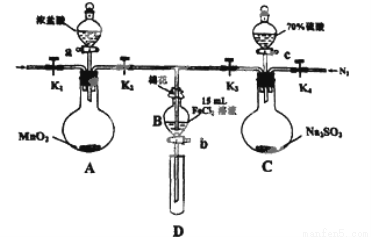
(1)过程Ⅰ的目的是______________________。
(2)棉花中浸润的溶液为__________________。
(3)A中发生反应的化学方程式为__________________________________。
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是______________
(5)过程Ⅵ中检验B溶液中是否含有硫酸根的操作是________________________________
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是
| 过程IV B溶液中含有的离子 | 过程VI B溶液中含有的离子 |
甲 | 有Fe3+无Fe2+ | 有SO42﹣ |
乙 | 既有Fe3+又有Fe2+ | 有SO42﹣ |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com