
下列反应中,属于取代反应的是
①CH3CH=CH2+Br2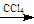 CH3CHBrCH2Br
CH3CHBrCH2Br
②CH3CH2OH CH2=CH2↑+H2O
CH2=CH2↑+H2O
③CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
④C6H6+HNO3 C6H5NO2+H2O
C6H5NO2+H2O
A. ①② B.②④ C.①③ D.③④
科目:高中化学 来源:2015-2016学年四川省高二上第二次段考化学试卷(解析版) 题型:选择题
1,3?丁二烯合成氯丁橡胶的过程中, 是一种中间产物。下列说法正确的是
是一种中间产物。下列说法正确的是
A.1,3?丁二烯中所有原子一定在同一平面上
B.1,3?丁二烯转化为 时,先与HCl发生1,2?加成再水解得到
时,先与HCl发生1,2?加成再水解得到
C. 在NaOH醇溶液中或浓硫酸存在时加热都能发生消去反应
在NaOH醇溶液中或浓硫酸存在时加热都能发生消去反应
D. 催化氧化得X,X能发生银镜反应,则X的结构有两种
催化氧化得X,X能发生银镜反应,则X的结构有两种
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高三上第三次模拟考试化学试卷(解析版) 题型:选择题
已知W、X、Y、Z为短周期元素,它们的原子半径依次增大,W与Z、X和Y分别同主族,Y、 Z同周期。Z能与X形成两种常见的离子化合物,离子个数比均为2:1。下列说法错误的是
A.Y、Z、X、W的原子序数依次减小
B.W与X可形成既含极性共价键又含非极性共价键的化合物
C.由W、X、Y、Z四种元素组成的常见化合物一定显酸性
D.X的简单氢化物的沸点低于Y的简单氢化物的沸点
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三上学期期中考试化学试卷(解析版) 题型:填空题
在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+ I2(g) 2HI(g) ΔH<0。反应中各物质的浓度随时间变化情况如图1:
2HI(g) ΔH<0。反应中各物质的浓度随时间变化情况如图1:
(1)该反应的化学平衡常数表达式为 。
(2)根据图1数据,反应开始至达到平衡时,平均速率v(HI)为 。

(3)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K (填写增大、减小或不变),HI浓度的变化正确的是 (用图2中a-c的编号回答)。
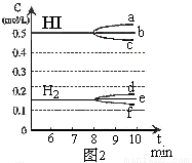
②若加入I2,则H2浓度的变化正确的是 (用图2中d-f的编号回答)。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列有关化学与生活的叙述错误的是
A.利用太阳能、潮汐能、风力发电,可以获取清洁能源
B.常在包装袋内放入生石灰以防止月饼等富脂食品氧化变质
C.利用可降解的“玉米塑料”生产一次性饭盒,可防止白色污染
D.采用纳米二氧化钛光触媒技术可将汽车尾气中的NO和CO转化为无害气体
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川九中高三上学期第三次月考理综化学试卷(解析版) 题型:填空题
2015年8月12日晚11时20分左右,天津港国际物流中心区域内瑞海公司所属危险品仓库发生的爆炸,造成了严重的人员伤亡,据瑞海国际官网信息,该公司仓储含以下种类物质:压缩气体天然气、易燃液体甲醇、乙酸乙酯、遇湿易燃物品电石、氰化钠、腐蚀品硫化碱等。
(1)由于CaC2、金属钠、金属钾以及固体NaH等物质能够跟水反应给灾后救援工作带来了很多困难。如果在实验室,你处理金属钠着火的方法是 。(填序号)其中固体NaH与水反应的方程式为
A.泡沫灭火器 B.消防车喷水 c.沙土
(2)硫化碱其实就是我们常见的硫化钠,触及皮肤和毛发时会造成灼伤。①其水溶液呈强碱性,故俗称硫化碱。 ②其水溶液在空气中会缓慢地氧化成Na2S2O3,该反应中还原剂与氧化剂物质的量之比为 。
(3)以上易燃液体甲醇是一种可再生能源,具有开发 和应用的广阔前景,如:

①2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图1所示.
该电池正极的电极反应式为 ;负极的电极反应式 ;工作一段时间后,当6.4g甲醇完全反应生成CO2时,有 个电子发生转移.
②以上述电池做电源,用图2所示装置模拟氯碱工业,若只有铝棒和碳棒两个电极,则与电源负极相连的是 (铝棒或碳棒),写出电解该溶液总反应方程式
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一上12月月考化学试卷(解析版) 题型:填空题
某固体混合物中,可能含有下列离子中的几种:K+、NH4+、Mg2+、Ba2+、Cl-、SO42-、CO32-,将该混合物溶于水后得澄清溶液,现取三份各100mL该溶液分别进行如下实验:
(1)在一份溶液中加入AgNO3溶液,有白色沉淀生成;
(2)在另一份溶液中加入足量的NaOH溶液并加热,收集到1.12L气体(标准状况下);
(3)在第三份溶液中加入足量的BaCl2溶液有沉淀生成,经称量其质量为6.27g,在该沉淀中加入足量的盐酸,沉淀部分溶解,剩余固体质量为2.33g。
根据上述实验回答下列问题:
①溶液中一定不存在的离子是____________;
②溶液中一定存在的阴离子有________,其物质的量浓度分别为__________;
③推断K+是否存在并说理由:_________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上12月月考化学试卷(解析版) 题型:填空题
二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.
请回答下列问题:
(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:_____ _____.
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g);△H=﹣90.8kJ•mol﹣1
②2CH3OH(g)═CH3OCH3(g)+H2O(g);△H=﹣23.5kJ•mol﹣1
③CO(g)+H2O(g)═CO2(g)+H2(g);△H=﹣41.3kJ•mol﹣1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2 (g) △H=___________;则该反应( )
A.任何温度下都能进行
B.任何温度下都不能进行
C.高温下能自发进行
D.低温下能自发进行
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(以上都填字母代号).
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(3)已知反应②2CH3OH(g)═CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol•L﹣1) | 0.44 | 0.6 | 0.6 |
①比较此时正、逆反应速率的大小:v正__________ v逆 (填“>”、“<”或“=”).
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=__________.
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二上12月月考化学试卷(解析版) 题型:选择题
在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A.Ⅰ中气体由无色变红棕色的化学方程式:2NO+O2==2NO2
B.进一步反应对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
C.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com