
【题目】能源开发、环境保护、资源利用等是当今社会的热门话题。请根据所学化学知识回答下列问题:
(1)汽车上安装催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
已知:N2(g) + O2(g)=2NO(g) △H=+180.5 kJ · mol-1;
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ · mol-1;
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ · mol-1;
则尾气转化反应2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=________________。
(2)汽车尾气分析仪对CO的含量分析是以燃料电池为工作原理,其装置如下图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质中自由移动。

下列说法中正确的是_____________(填字母序号)。
A.负极的电极反应式为:CO + O2-―2e-=CO2
B.工作时电子由电极a通过传感器流向电极b
C.工作时电极b作正极,O2-由电极a通过固体介质向电极b迁移
D.传感器中通过的电流越大,尾气中CO的含量越高
(3)某硝酸厂利用甲醇处理废水。在一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比为______________。
(4)煤的间接液化是先转化为CO和H2,再在催化剂作用下合成甲醇。若在一定温度下,向1 L密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下:
CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下:
物 质 | CO | H2 | CH3OH |
浓度/(mol·L-1) | 1.2 | 1.0 | 0.6 |
①该反应的平衡常数表达式为:K=_____________________。
②该时间内反应速率υ(H2)=_________________。
③平衡时CO的转化率为_________________(保留1位小数)。
【答案】-746.5 kJ · mol-1 A B D 5 : 6 ![]() 0.12 mol/(L·min) 33.3%
0.12 mol/(L·min) 33.3%
【解析】
(1)依据盖斯定律计算热化学方程式;
(2)燃料电池中燃料在负极失电子发生氧化反应,氧气在正极得到电子发生还原反应,电子从负极沿外电路流向正极,注意O2-可以在固体介质中自由移动;
(3)根据消耗甲醇的量和转移电子的物质的量来书写方程式,并确定氧化剂和还原剂的量的比;
(4)列三段式进行分析。
(1)①N2(g)+O2(g)=2NO(g)△H=+180.5kJ · mol-1;
②2C(s)+O2(g)=2CO(g)△H=-221.0kJ · mol-1;
③C(s)+O2(g)=CO2(g)△H=-393.5kJ · mol-1
依据盖斯定律③×2-①-②得到 2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=(-393.5kJ · mol-1)×2-180.5kJ · mol-1-(-221.0kJ · mol-1)=-746.5kJ · mol-1;
(2)由图可知,在负极一氧化碳失电子生成二氧化碳,电池中电解质为氧化钇-氧化钠,正极氧气得电子生成O2-,其中O2-可以在固体介质中自由移动
A.在负极一氧化碳失电子生成二氧化碳,负极的电极反应式为:CO+O2--2e-=CO2 ;故A正确;
B.工作时,电子由负极沿外电路流向正极,电子由电极a通过传感器流向电极b,故B正确;
C.工作时电极b作正极,O2-由电极b通过固体介质向电极a迁移,故C错误;
D.传感器中通过的电流越大,一氧化碳失电子越多,尾气中CO的含量越高,故D正确;
故选A B D;
(3)消耗32g(1mol)CH3OH转移6mol电子,CH3OH中碳元素的化合价为-2价,则反应后碳的化合价为+4,生成CO2,根据化合价升降总数相等、结合原子守恒得:5CH3OH+6HNO3═5CO2↑+3N2↑+13H2O,氧化剂是硝酸,还原剂是甲醇,参加反应的还原剂和氧化剂的物质的量之比是5:6;
(4)①发生反应CO(g)+2H2(g)![]() CH3OH(g),依据平衡常数定义写出为K=
CH3OH(g),依据平衡常数定义写出为K=![]() ;
;
②发生反应达到平衡,物质的浓度已知,可以依据三段式列式计算;
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始量(mol·L-1) 1.8 2.2 0
变化量(mol·L-1) 0.6 1.2 0.6
平衡量(mol·L-1) 1.2 1.0 0.6
υ(H2)=1.2mol·L-1÷10min=0.12 mol/(L·min);
③依据②计算平衡时一氧化碳转化率=![]() ×100%=33.3%。
×100%=33.3%。


 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
【题目】化合物H具有类似龙涎香、琥珀香的气味,香气淡而持久,被广泛用作香精的稀释剂和定香剂。合成该化合物的某种途径如图所示。
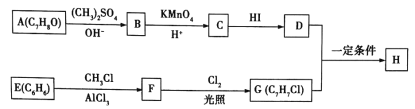
已知以下信息:
①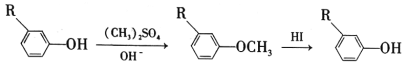 ;
;
②A的苯环上有四种化学环境不同的氢原子,且取代基的位置相邻;
③在D中滴加几滴FeCl3溶液,发生反应显出颜色;
④芳香烃F的相对分子质量介于90~100之间,0.1molF充分燃烧可生成7.2g水;
⑤R1COOH+RCH2C1![]() R1COOCH2R+HCl。
R1COOCH2R+HCl。
回答下列问题:
(1)A的化学名称是___________,由C生成D的反应的化学方程式为_______________。
(2)由F生成G的反应的化学方程式为____________________,反应类型为________________。
(3)H的结构简式为__________________。
(4)苯环上有三个取代基且其中两个与A中所含的官能团相同,同时又能发生银镜反应的C的同分异构体有___________(不考虑立体异构)种,其分子中有5种化学环境不同的氢原子,且氢原子个数之比为1:2:2:2:1的同分异构体的结构简式是_____________(任写一种即可)。
(5)苯酚经下图所示步骤可合成化合物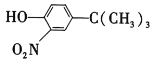 。
。
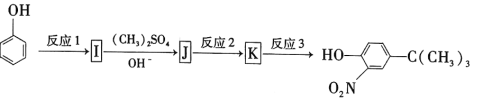
反应1所用的试剂为____________,K的结构简式为___________,反应3所用的试剂为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池工作时发生复杂的铜腐蚀现象,电池总反应为:2Li+Cu2O+H2O=2Cu+2Li++2OH-,其工作原理如图所示,下列说法不正确的是( )
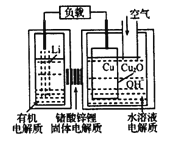
A. 电池放电时,正极附近溶液pH增大
B. 工作时,Li′透过固体电解质向Cu极移动
C. 电池放电过程中,空气中的O2并不参加反应
D. 两极的有机电解质和水溶液电解质不可对换
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在生活及工业生产中有着重要应用。请回答以下问题:
(1)如图是N2(g)、H2(g)与NH3(g)之间转化的能量关系图,则:
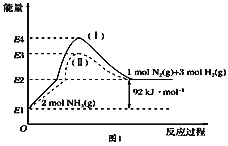
①N2(g)与H2(g)反应生成NH3(g)的热化学方程式为___________________.
②过程(Ⅰ)和过程(Ⅱ)的反应热________(填“相同”或“不同”).
③某温度下,在1 L恒温恒容容器中充入1molN2和3 mol H2进行上述反应,10 min达到平衡,此时容器内压强变为原来的7/8.
a.该过程的平衡常数的表达式为____________.
b.N2的平衡转化率为________.
c.此时若保持容器温度和体积不变,向其中再加入2.25 molN2和0.5 mol NH3,则平衡________(填“正向”“逆向”或“不”)移动.
(2)用NH3可以消除氮氧化物的污染,已知:
反应Ⅰ:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1
2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1
反应Ⅱ:N2(g)+O2(g)![]() 2NO(g) ΔH2=b kJ·mol-1 平衡常数为K2
2NO(g) ΔH2=b kJ·mol-1 平衡常数为K2
反应Ⅲ:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常数为K3
5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常数为K3
则反应Ⅱ中的b=_____(用含a、c的代数式表示),K3=_____(用K1和K2表示).反应Ⅲ中的ΔS______(填“>”“<”或“=”)0.
(3)在恒容的密闭器中,充入一定量的NH3和NO进行上述反应Ⅲ,测得不同温度下反应体系中NH3的转化率(α)与压强p的关系如图所示:
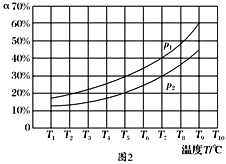
①分析得p1________p2.(填“>”“<”或“=”)
②下列叙述中,不能作为判断反应Ⅲ已经达到平衡状态的标志的是________(填序号).
a.N2的浓度不再改变 b.断裂6 mol N—H键的同时,有6 mol H—O键形成
c.容器中压强不再变化 d.混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料。
(1)以下是工业上合成甲醇的两个反应:
反应I: CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g) ![]() H1
H1
反应II:CO2(g)+3H2(g)![]() CH3OH(g)+ H2O(g)
CH3OH(g)+ H2O(g) ![]() H2
H2
①上述反应符合“原子经济”原则的是____________(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应I在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断反应I为______________热反应(填“吸”或“放”)。
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分发生反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为_______,此时的温度为_______(从表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ![]() H1kJ/mol
H1kJ/mol
②2CO(g)+O2(g)=2CO2(g) ![]() H2kJ/mol
H2kJ/mol
③H2O(g)=H2O(l) ![]() H3 kJ/mol
H3 kJ/mol
则反应 CH3OH(l)+ O2(g)= CO(g)+ 2H2O(l) ![]() H=________kJ/mol
H=________kJ/mol
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72)时,实验室利用如图装置模拟该法:
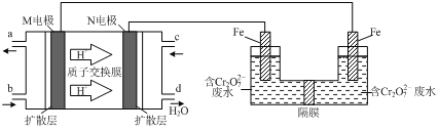
①N电极的电极反应式为____________。
②请完成电解池中Cr2O72-转化为Cr3+的离子反应方程式:
Cr2O72-+_______Fe2+ +________ [___]═ ________Cr3++_______Fe3++_________[___]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)达到平衡,保持温度不变,加入少量水蒸气,体系重新达到平衡,下列说法正确的是
Fe3O4(s)+4H2(g)达到平衡,保持温度不变,加入少量水蒸气,体系重新达到平衡,下列说法正确的是
A.水蒸气的体积分数增大B.氢气的浓度增大
C.平衡常数变大D.铁的质量增大
查看答案和解析>>
科目:高中化学 来源: 题型:
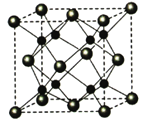
【题目】[化学—选修3:物质结构与性质](15分)A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲烷的电子式为_____,其空间结构为_____;乙烯的结构简式为_____,乙烯通入溴水中的化学方程式为_____,其反应类型为_____,C5H12的烃有_____种同分异构体
(2)一装有等体积氯气和甲烷的量筒倒扣在盛水的水槽中,放在室外一段时间后,可观察到的现象是量筒内气体颜色变浅、_____、_____、量筒内液面上升,写出该反应生成一氯甲烷的化学方程式_____,该反应类型为_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化性:Br2 > Fe3+> I2,向含 a mol FeI2 和 a mol BaCl2 的混合溶液中缓慢通入 b mol Br2,并不断搅拌,溶液中离子的物质的量随 Br2加入的变化如图所示(不考虑盐类水解、水的电离及溶液体积变化)。则下列说法不正确的是( )
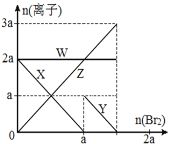
A.离子的还原性 I-> Fe2+> Br-
B.四条线与溶液中离子的对应关系是: X-Fe2+、Y-I-、Z-Br-、W-Cl-
C.当4a =3b时,反应后的离子浓度比:c(Fe2+):c(Fe3+):c(Br-) = 1:2:8
D.当3a≤2b时,发生的离子方程式:2Fe2++ 4I-+ 3Br2=2Fe3++ 2I2+6Br-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com