
下表为周期表的一部分,其中的编号代表对应不同的元素。
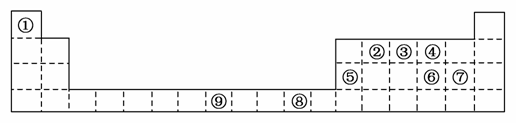
请回答下列问题。
(1)表中属于d区的元素是________(填编号);元素⑧的原子外围电子排布式是________。
(2)③和⑦形成的常见化合物的晶体类型是________;②③④的电负性:________>________>________(用元素符号表示)。判断依据是______________________________,气态氢化物最稳定的是________(写化学式);
(3)某元素的特征电子排布式(价电子排布式)为nsnnpn+1,该元素为周期表中的________(填编号);该元素与元素①形成的化合物X极易溶于水的原因是__________________________。
(4)②③形成一种超硬、耐磨、耐高温的新型无机非金属材料,则其化学式为________________,其熔点比金刚石的__________(填“高”或“低”)。
(5)⑤的氧化物与⑥的最高价氧化物的水化物反应的方程式为______________________。
解析 (1)由各元素在周期表中的位置可知①至⑨各元素分别为H、C、N、O、Al、S、Cl、Cu、Fe,属于d区的是Fe,Cu的外围电子排布为3d104s1。
(2)N和Cl形成的常见化合物有NCl3、NCl5,均为分子晶体;由于周期表中同周期元素从左到右非金属性逐渐增强,电负性也逐渐增大,即C<N<O,非金属性越强,气态氢化物越稳定,故H2O比NH3、CH4稳定。
(3)由其价电子排布式可知,符合条件的为N元素,氨气和水都是极性分子,根据相似相溶原理可知NH3易溶于水,又由于氨分子与水分子间可形成氢键,使NH3更易溶于水。
(4)C、N形成的化合物为C3N4,由其超硬,耐高温等性质,可判断该化合物属于原子晶体,由于C—N键比C—C键短,C—N键键能更大,C3N4熔点更高。
(5)Al的氧化物为Al2O3,S的最高价氧化物的水化物为H2SO4,二者反应的方程式为Al2O3+3H2SO4===Al2(SO4)3+3H2O。
答案 (1)⑨ 3d104s1
(2)分子晶体 O N C 同周期元素从左到右的非金属性逐渐增强 H2O
(3)③ 氨气和水都是极性分子,氨气和水分子间可以形成分子间氢键
(4)C3N4 高
(5)Al2O3+3H2SO4===Al2(SO4)3+3H2O


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
下列实验中所选用的仪器或实验基本操作合理的是
①用l0mL量筒量取5.2 mL稀硫酸; ②用酒精洗涤粘有硫粉的试管: ③用托盘天平称量10.1 g氯化钠晶体: ④用过滤的方法除去淀粉胶体中的氯化钠溶液:⑤用饱和NaHCO3溶液除去CO2中的少量SO2
A.①②③④ B.②③④ C.③④⑤ D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关金属键的相关叙述,正确的是( )
A.金属中的电子属于整块金属
B.金属键是金属离子和自由电子之间存在的强烈的静电吸引作用
C.按熔点逐渐升高的顺序排列的是:Li、Na、Mg
D.固态能导电的单质一定为金属
查看答案和解析>>
科目:高中化学 来源: 题型:
下列晶体分类中正确的一组是( )
| 离子晶体 | 原子晶体 | 分子晶体 | |
| A | NaOH | Ar | SO2 |
| B | H2SO4 | 石墨 | S |
| C | CH3COONa | 水晶 | 白磷 |
| D | Ba(OH)2 | 金刚石 | 水晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用1 mol·L-1 NaOH溶液中和某浓度的硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示,原硫酸溶液的物质的量浓度和反应后溶液的总体积分别是( )
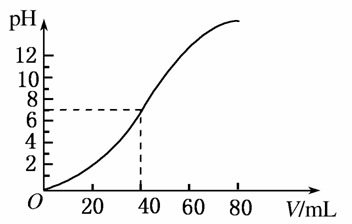
A.1 mol·L-1,60 mL B.0.5 mol·L-1,80 mL
C.0.5 mol·L-1,40 mL D.1 mol·L-1,80 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)相同物质的量浓度、相同体积的NaCl、MgCl2、AlCl3溶液,分别与足量的AgNO3溶液反应,生成沉淀的质量之比为 .
(2)向等体积、同浓度的AgNO3溶液中,分别加入相同体积的NaCl、MgCl2、AlCl3溶液,恰好使它们中的Cl﹣完全转化为AgCl沉淀,则三种溶液的物质的量浓度之比为 .
(3)Na、Mg、Al分别与足量的硫酸溶液反应,当生成气体的质量相同时,消耗掉的Na、Mg、Al的物质的量之比为 .
(4)足量的Al分别与等浓度的硫酸溶液、氢氧化钠溶液反应,当生成气体的质量相同时,硫酸溶液和氢氧化钠溶液的体积比为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com