
已知在加热的条件下:2NaHCO3![]() Na2CO3+CO2↑+H2O按以下装置图进行实验,填写有关现象及化学方程式:
Na2CO3+CO2↑+H2O按以下装置图进行实验,填写有关现象及化学方程式:
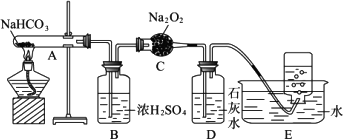
(1)B中浓硫酸的作用是________.
(2)C中发生反应的化学方程式为________.
(3)D中现象是________,反应的化学方程式是________.
(4)E中收集的气体是________.
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
| c(NH4+) | c(H+) |
查看答案和解析>>
科目:高中化学 来源:设计必修一化学鲁科版 鲁科版 题型:058
已知在加热的条件下浓硫酸能将碳单质氧化生成CO2和少量CO,而浓硫酸本身被还原成SO2,已知混合气体中CO2的量是CO的5倍.
(1)写出该反应的化学方程式:________.
(2)若用如图所示装置证明H2SO4的还原产物为SO2,碳的氧化产物之一有CO2,则装置连接顺序为(填装置的管口编号)________(所有装置不一定全选用,也可重复选用).

(3)按上述(2)连接进行实验,仍存在一个明显不足:________,试用文字表述改进方法:________.
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)写出该反应的化学方程式: _________________。
(2)若用下图所示装置证明H2SO4的还原产物为SO2,碳的氧化产物之一有CO2,则装置连接顺序为(填装置的管口编号)_________________(所有装置不一定全选用,也可重复选用)。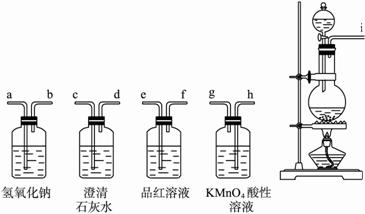
(3)按上述(2)连接进行实验,仍存在一个明显不足,试用文字表述改进方法:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)写出该反应的化学方程式: _________________。
(2)若用下图所示装置证明H2SO4的还原产物为SO2,碳的氧化产物之一有CO2,则装置连接顺序为(填装置的管口编号)_________________(所有装置不一定全选用,也可重复选用)。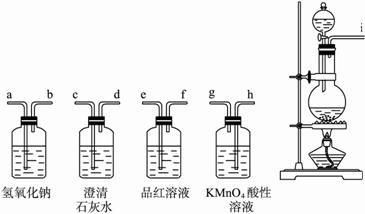
(3)按上述(2)连接进行实验,仍存在一个明显不足,试用文字表述改进方法:____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com