


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:阅读理解
 (2010?四川)碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.请回答下列问题:
(2010?四川)碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.请回答下列问题:| 实验方法 | 实验现象及结论 |
取少量阳极区电解液于试管中,加稀硫酸酸化后加入几滴淀粉溶液,观察是否变蓝. 取少量阳极区电解液于试管中,加稀硫酸酸化后加入几滴淀粉溶液,观察是否变蓝. |
如果不变蓝,说明无I-.(如果变蓝,说明有I-) 如果不变蓝,说明无I-.(如果变蓝,说明有I-) |

查看答案和解析>>
科目:高中化学 来源: 题型:
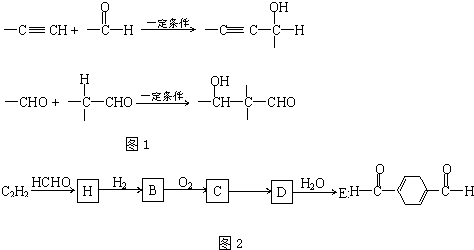




 等
等 等
等查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
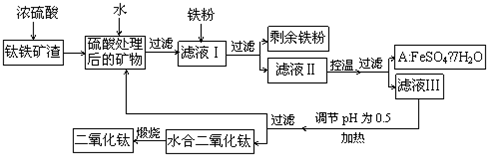
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com