
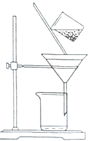
| A. | 漏斗末端颈尖未紧靠烧杯壁 | |
| B. | 玻璃棒用作引流 | |
| C. | 将滤纸湿润,使其紧贴漏斗壁 | |
| D. | 滤纸边缘高出漏斗 | |
| E. | 用玻璃棒在漏斗中轻轻搅动以加快过滤速度. |
分析 过滤遵循一贴二低三靠.一贴:过滤时,为了保证过滤速度快,而且避免液体顺着漏斗与滤纸间的夹缝流下,滤纸应紧贴漏斗内壁,且中间不要留有气泡.
二低:如果滤纸边缘高于漏斗边缘,过滤器内的液体极有可能溢出;如果漏斗内液面高于滤纸边缘,液体也会顺着漏斗与滤纸间的夹缝流下,这样都会导致过滤失败.
三靠:倾倒液体的烧杯口要紧靠玻璃棒,是为了使液体顺着玻璃棒缓缓流下,避免了液体飞溅;玻璃棒下端如果紧靠一层滤纸处,万一玻璃棒把湿的滤纸戳破,液体就会顺着漏斗与滤纸间的夹缝流下,导致过滤失败,而靠在三层滤纸处则能避免这一后果;漏斗下端管口的尖嘴要紧靠承接滤液的烧杯内壁,可以使滤液顺着烧杯内壁流下,避免了滤液从烧杯中溅出.总之,“一贴、二低、三靠”,都是为了保证过滤实验操作成功,据此分析解答.
解答 解:A.漏斗末端颈尖未紧靠烧杯壁,应漏斗末端颈尖紧靠烧杯壁,故A错误;
B.玻璃棒用作引流,使液体顺利流下,故B正确;
C.将滤纸湿润,使其紧贴漏斗壁,防止液体从滤纸与漏斗的缝隙流下,故C正确;
D.滤纸边缘应低于漏斗上边缘,故D错误;
E.玻璃棒不能在漏斗中轻轻搅动以加过过滤速度,可能捣破滤纸,过滤失败,故E错误;
故答案为:ADE.
点评 本题考查设计过滤实验应遵循的三个要点,既要知其然,更要知其所以然,才能一一答对,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目 的 | 分离方法 | 原 理 |
| A | 分离溶于水的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B | 分离汽油和四氯化碳 | 分液 | 四氯化碳和汽油的密度不同 |
| C | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
| D | 除去乙酸中的乙醚 | 蒸馏 | 乙酸与乙醚的沸点相差较大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
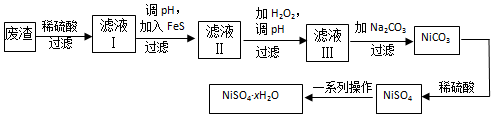
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
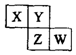 短周期元素X、Y、Z、W在元素周期表中的位置关系如图所示.若Y原子最外层电子数是内层电子数的3倍,下列说法正确的是( )
短周期元素X、Y、Z、W在元素周期表中的位置关系如图所示.若Y原子最外层电子数是内层电子数的3倍,下列说法正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 最高正化合价:Z>W>X | |
| C. | 氢化物溶液的pH:W>X | |
| D. | 四种元素的单质中,Z单质的熔沸点最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com