
【题目】稀土元素是指元素周期表中原子序数为57到71的15种镧系元素,以及与镧系元素化学性质相似的钪(Sc)和钇(Y)共17种元素。稀土元素有“工业维生素”的美称,如今已成为极其重要的战略资源。
(1)钪(Sc)为21号元素,位于周期表的_____区,基态原子价电子排布图为_______。
(2)离子化合物Na3[Sc(OH)6]中,存在的化学键除离子键外还有_______。
(3)Sm(钐)的单质与l,2-二碘乙烷可发生如下反应:Sm +ICH2CH2I→SmI2+CH2=CH2。ICH2CH2I中碳原子杂化轨道类型为______, lmol CH2=CH2中含有的σ键数目为______。常温下l,2-二碘乙烷为液体而乙烷为气体,其主要原因是__________
(4)与N3-互为等电子体的分子有________________(写两个化学式)。
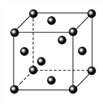
(5)Ce(铈)单质为面心立方晶体,其晶胞参数a=516pm。晶胞中Ce(铈)原子的配位数为_______,列式表示Ce(铈)单质的密度:________g/cm3(用NA表示阿伏伽德罗常数的值,不必计算出结果)
【答案】 d ![]() 共价键和配位键 sp3 3.01×1024或5NA 二碘乙烷的相对分子质量较大,分子间作用力较强,沸点相对较高 N2O、CO2、CS2、BeF2等 12
共价键和配位键 sp3 3.01×1024或5NA 二碘乙烷的相对分子质量较大,分子间作用力较强,沸点相对较高 N2O、CO2、CS2、BeF2等 12 ![]() 或
或![]()
【解析】(1). 钪(Sc)为21号元素,根据核外电子排布规律可知钪(Sc)的核外电子排布式为:1s22s22p63s23p63d14s2,位于元素周期表的d区,基态原子价电子排布图为![]() ,故答案为:d;
,故答案为:d;![]() ;
;
(2). 离子化合物Na3[Sc(OH)6]中,存在的化学键除离子键外还有O与H之间的共价键,以及Sc与氢氧根离子之间的配位键,故答案为:共价键和配位键;
(3). ICH2CH2I中碳原子是饱和碳原子,其杂化轨道类型为sp3,CH2=CH2中单键都是σ键,双键中含有1个σ键,所以1个CH2=CH2中含有5个σ键,则1molCH2=CH2中含有的σ键数为3.01×1024或5NA,由于二碘乙烷的相对分子质量较大,分子间作用力较强,沸点相对较高,所以常温下1,2-二碘乙烷为液体而乙烷为气体,故答案为:sp3;3.01×1024或5NA;二碘乙烷的相对分子质量较大,分子间作用力较强,沸点相对较高;
(4). 根据等电子体的定义可知,与N3-互为等电子体的分子有N2O、CO2、CS2、BeF2等,故答案为:N2O、CO2、CS2、BeF2等;
(5). Ce(铈)单质为面心立方晶体,根据晶胞结构示意图可知,在Ce晶体的一个晶胞中与它距离相等且最近的Ce原子在通过这个顶点的三个面心上,面心占1/2,通过一个顶点可形成8个晶胞,因此该晶胞中Ce原子的配位数为8×3×1/2=12,根据均摊法可知,一个晶胞中Ce原子个数为:8×1/8+6×1/2=4个,因此Ce的密度ρ=m÷V=![]() 或
或![]() ,故答案为:12;
,故答案为:12;![]() 或
或![]() 。
。


科目:高中化学 来源: 题型:
【题目】I.下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)从氯化钾溶液中得到氯化钾固体,选择装置________(填代表装置图的字母,下同);除去自来水中 的Cl-等杂质,选择装置________________。
(2)从碘水中分离出I2,选择装置________,该分离方法的名称为________________。
(3)装置A中①的名称是________,进水的方向是从________口进水。
II.某化学课外小组用海带为原料制取了少量碘水.现用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液.其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50 mL碘水和15 mL CCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.放开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层水溶液;
G.将漏斗上口的玻璃塞打开,或使溶液上的凹槽或小孔对准漏斗口上的小孔;
H.静置、分层.
就此实验,完成下列填空:
(1)正确操作步骤的顺序是(用上述各操作的编号字母填空):
________→________→________→A→H→________→E→F._____________
(2)上述E步骤的操作中应注意______________________________________.上述G步骤操作的目的是_____________________________________________.
(3)能选用CCl4从碘水中萃取碘的原因是______________________________________.
(4)下列物质不能作为从溴水中萃取溴的溶剂是________.
A.酒精 B.苯(一种有机溶剂,与水互不相溶,密度比水小) C.汽油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量氯气通入盛有KI和KBr混合液的烧杯中,完全反应后,将溶液蒸干,灼烧,最后烧杯中剩余的固体是( )
A.KCl和I2
B.I2
C.KCl
D.KCl、Br2和I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下图,下列叙述正确的是

A. 若该图表示的是活细胞的各化学元素的含量,则甲为碳元素
B. 若该图表示的是细胞各化学元素占干重的百分比,则甲为氧元素
C. 若该图为活细胞的化合物组成情况,则甲中含有的元素为C、H、0
D. 若该图是完全脱水后的细胞的化合物组成情况,则甲是蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下发生下列反应,其中属于盐类水解反应的是
A. NH4+ + 2H2O![]() NH3·H2O + H3O+ B. HCO3-+H2O
NH3·H2O + H3O+ B. HCO3-+H2O![]() H3O+ + CO32-
H3O+ + CO32-
C. HS- + H3O+ ![]() H2S + H2O D. Cl2 + H2O
H2S + H2O D. Cl2 + H2O ![]() H+ + Cl- + HClO
H+ + Cl- + HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是有关组成细胞主要化合物的概念图,回答下列问题:
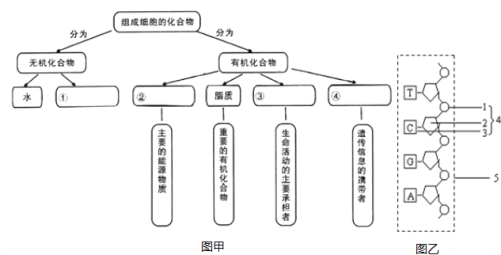
(1)写出图甲中化合物的名称:①____,③____。
(2)图甲的中④组成元素为________________。
(3)图乙为图甲中④的一条长链,2、3的名称分别是____、______。该结构中特有的碱基名称是______。(要求写中文全称)
(4)生物体内的③的共同的化学元素是_______。若a个氨基酸组成b条链,组成某种物质③,该物质③至少有氧原子的个数是_____。
(5)SARS病毒体内物质④彻底水解后,产生的物质有磷酸、____、______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的图解表示构成生物体的元素、化合物及其作用,其中a、b、d、e代表小分子,A、B、E、F代表不同的分子量较大的物质,请据图回答下列问题:
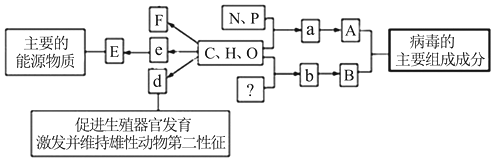
(1)e是细胞中主要的能源物质,被人称为“生命的燃料”,则e是___,E在植物细胞中主要是指_________,E在人体中主要分布于 ______ 细胞。
(2)在HIV(人类免疫缺陷病毒)中物质A的中文名称是___________,其基本组成单位a有______种。
(3)物质d是______;物质F是______,并且由于其储存能量多而且所占体积小,是生物体内重要的储能物质。等质量的物质F与物质E相比,物质F储存的能量多,从元素的含量上看,原因是 _____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)含氢原子8g的CH4所含原子总数是标况下____升H2所含原子总数的二倍。
(2)标况下,W g CO2与4.48 LH2的混合气体的总体积等于32g CH4的体积,求W=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于盐溶液呈酸碱性的说法错误的是( )
A. 盐溶液呈酸碱性的原因是破坏了水的电离平衡
B. ![]() 溶液呈酸性是由于溶液中
溶液呈酸性是由于溶液中![]()
C. 在![]() 溶液中,由水电离的
溶液中,由水电离的![]()
D. 水电离出的![]() 和
和![]() 与盐中弱酸阴离子或弱碱阳离子结合,造成盐溶液呈碱性或酸性
与盐中弱酸阴离子或弱碱阳离子结合,造成盐溶液呈碱性或酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com