
下列分子中的中心原子杂化轨道的类型相同的是 ( )。
A.SO3与SO2 B.BF3与NH3
C.BeCl2与SCl2 D.H2O与SO2
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
控制适合的条件,将反应2Fe3++2I-??2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是( )
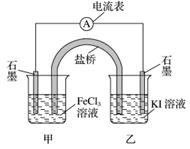
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流表读数为零时,反应达到化学平衡状态
D.电流表读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物C是某合成路线的中间体,可通过下列方法合成:
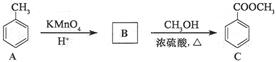
回答下列问题:
(1)在催化剂作用下,A与氢气反应的化学方程式为 ,反应类型为 。
(2)B的结构简式为 ,所得B的粗产品通常用 的方法提纯。
(3)在C的制备中,浓硫酸的作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
气态反应 A(g)+3B(g) ==2C(g)+2D(g),在四种不同条件下的反应速率最快的是
A、v(A)=0.15 mol/(L·s) B、 v(B)=0.8 mol/(L·s)
C、v(C)=0.4 mol/(L·s) D、 v(D)=0.6 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应4NH3(g)+5 O2 (g)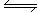 4NO (g)+6H2O (g)。回答下列问题:
4NO (g)+6H2O (g)。回答下列问题:
(1)在一定温度下,向一个5 L的密闭容器中充入0.20 mol的NH3和0.80 mol的O2,如反应初始6min内NH3的平均反应速率v(NH3)=0.003 mol·L-1·min-1,则6 min时c(O2)=___mol·L-1,NO的物质的量为________mol;反应一段时间后,达到平衡状态,如果这时向该密闭容器中再充入1 mol氩气,平衡时NH3的转化率________。(填“增大”“不变”或“减小”)
(2)判断该反应是否达到平衡的依据为________(填正确选项前的字母):a.体系压强不随时间改变 b.气体的密度不随时间改变 c.c(NH3)不随时间改变 d.单位时间里生成NO和H2O (g)的物质的量之比为4:6
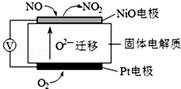 (3)氮的氧化物NOx是大气污染的主要污染物之一,通过NOx传感器可监测NOx的含量,其工作原理示意图如右:(工作原理和燃料电池类似)①Pt电极为 极(填正、负);NiO电极发生 反应(填“氧化”或“还原”).
(3)氮的氧化物NOx是大气污染的主要污染物之一,通过NOx传感器可监测NOx的含量,其工作原理示意图如右:(工作原理和燃料电池类似)①Pt电极为 极(填正、负);NiO电极发生 反应(填“氧化”或“还原”).
②写出NiO电极的电极反应式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质:①H3O+ ②[Cu(NH3)4]2+ ③CH3COO- ④NH3 ⑤CH4中存在配位键的是 ( )。
A.①② B.①③ C.④⑤ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的性质与应用对应关系不正确的是
A.亚硫酸钠有还原性,可用作脱氧剂 B.FeCl3有氧化性,可用于制印刷电路
C.铝有还原性,可冶炼某些金属 D.浓硫酸有吸水性,可用于干燥氨气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com