
| A. | 动物体内的葡萄糖被氧化为CO2的过程是热能转化为化学能的过程 | |
| B. | 植物的光合作用是把太阳能转化为热能的过程 | |
| C. | 化石燃料和植物燃料燃烧时放出的能量均来源于太阳能 | |
| D. | 电解饱和食盐水是把化学能转化为电能 |
分析 A.动物体内葡萄糖被氧化成CO2是化学能转化为热能;
B.光合作用是太阳能转变成化学能;
C.化石燃料和植物燃料具备化学能,化学能来源于太阳能;
D.电解是将电能转化为化学能的装置.
解答 解:A.动物体内葡萄糖被氧化成CO2是化学能转变成热能的过程,故A错误;
B.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成化学能的过程,故B错误;
C.植物进行光合作用制造有机物,储存能量,植物死后,其尸体的一部分被腐生细菌或是真菌分解,剩下的植物的这些残骸经过一系列的演变形成了煤炭.所以煤中储存的能量来源于植物,植物中的能量来源于太阳能(或光能),所以化石燃料和植物燃料燃烧时放出的能量均来源于太阳能,故C正确;
D.电解是将电能转化为化学能的装置,故D错误;
故选C.
点评 本题考查能量的转换形式,题目难度不大,注意掌握能源的分类及合理使用方法,试题有利于增强学生的科学素养,提高学习化学的兴趣.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
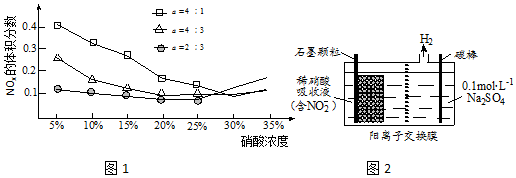
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
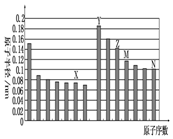
| A. | Z、N两种元素形成的化合物熔融状态下可以导电 | |
| B. | X、N两种元素的气态氢化物的沸点相比,前者较低 | |
| C. | Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液中 | |
| D. | 由X与M两种元素组成的化合物能与水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与W可以形成Na2W2化合物 | |
| B. | Z与少量的氢氧化钠溶液反应生成两性氢氧化物 | |
| C. | X与氢元素只能形成含共价键的化合物 | |
| D. | WO2与XO2均为酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
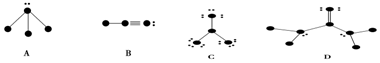
| A. | 键长越长,键能越小,共价化合物越稳定 | |
| B. | 通过反应物和生成物分子中键能数据可以粗略预测反应热的大小 | |
| C. | 键角是确定多分子立体结构(分子形状)的重要参数 | |
| D. | 同种原子间形成的共价键键长长短总是遵循:叁键<双键<单键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ),其原理如下图所示,下列说法正确的是( )
),其原理如下图所示,下列说法正确的是( )
| A. | A极的电极反应式为  +e-=Cl-+ +e-=Cl-+ | |
| B. | 当外电路中有0.2mole-转移时,A极区增加的H+的个数为0.1NA | |
| C. | 电流方向从B极沿导线经小灯泡流向A极 | |
| D. | B为电池的正极,发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
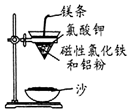 铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等.
铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com