
| A. | 澄清溶液中:AlO2-、SO42-、Na+、HCO3- | |
| B. | 在由水电离出的c(OH-)=10-13 mol•L-1的溶液中:I-、K+、Cl-、Ba2+ | |
| C. | 滴加甲基橙显红色的溶液:Fe2+、NH4+、SO42-、NO3- | |
| D. | c(H+)=c(OH-)的溶液:Fe3+、K+、Cl-、SO42- |
分析 A.AlO2-促进HCO3-的电离;
B.由水电离出的c(OH-)=10-13 mol•L-1的溶液,为酸或碱溶液;
C.滴加甲基橙显红色的溶液,显酸性,离子之间发生氧化还原反应;
D.c(H+)=c(OH-)的溶液,显中性.
解答 解:A.AlO2-促进HCO3-的电离,不能大量共存,故A错误;
B.由水电离出的c(OH-)=10-13 mol•L-1的溶液,为酸或碱溶液,酸、碱溶液中该组离子之间均不反应,可大量共存,故B正确;
C.滴加甲基橙显红色的溶液,显酸性,Fe2+、H+、NO3-发生氧化还原反应,不能大量共存,故C错误;
D.c(H+)=c(OH-)的溶液,显中性,中性溶液中不能大量存在Fe3+,故D错误;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)元素M是短周期元素,其常量存在于海水中,单质被誉为“国防金属”.
(1)元素M是短周期元素,其常量存在于海水中,单质被誉为“国防金属”.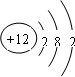 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n-2 | B. | n | C. | n-1 | D. | 2n |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 5 | D. | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:①将煤转化为水煤气的主要化学反应为C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g);
已知:①将煤转化为水煤气的主要化学反应为C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g);查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com