
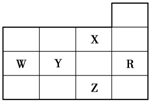
| A、其气态氢化物的稳定性是X>Y>W>Z |
| B、其最高价氧化物对应的水化物的酸性:Y>W |
| C、电负性、第一电离能的大小顺序都是X>Y>W |
| D、Y、Z的阴离子电子层结构都与R原子的相同 |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
| A、中和热测定实验中,用铜制环形搅拌器代替环形玻璃搅拌棒,所测中和热的数值 |
| B、配置一定物质的量浓度溶液时,定容后反复摇匀发现液面低于刻度,没有再加水,所得溶液的浓度 |
| C、配制一定物质的量浓度溶液时,用量筒量取浓溶液的体积时仰视读数,所得溶液的浓度 |
| D、用天平称量20.5g某物质,砝码和药品的位置放反,所得药品的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑦ | B、②⑥⑦ |
| C、①④⑧ | D、④⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、①② | C、②④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 物质 A、B 的溶解度曲线如图所示(A、B 均不与水反应且不含结晶水),下列叙述中正确的是( )
物质 A、B 的溶解度曲线如图所示(A、B 均不与水反应且不含结晶水),下列叙述中正确的是( )| A、T1℃时,A、B 饱和溶液中,A 溶液的溶质的质量分数较小 |
| B、T2℃时,A、B 饱和溶液的物质的量浓度相等 |
| C、可用加热浓缩、降温结晶的方法除去 B 中混有的少量 A |
| D、T1℃时 A、B 的饱和溶液升温至 T3℃时,B 溶液的溶质的质量分数较大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷可与水形成氢键这种化学键 |
| B、乙醇与水互溶可以用相似相溶原理解释 |
| C、H2O的熔点沸点大于H2S的是由于H2O分子之间存在氢键 |
| D、HF、HCl、HBr、HI的熔点沸点升高与范德华力大小有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | ||
| C | B | D |
| E |
| A、P | B、Mg | C、Cl | D、Si |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HB的电离方程式为:HB═H++B- |
| B、NaB溶液中:c(Na+)>c(B-)>c(H+)>c(OH-) |
| C、NaB溶液中存在如下关系:c(Na+)+c(H+)═c(HB)+c(B-) |
| D、0.1mol/L NaB溶液中水电离的OH-浓度大于10-7mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com