
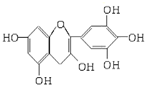
 茶是我国的传统饮品,茶叶中含有的茶多酚可以替代食品添加剂中对人体有害的合成抗氧化剂,用于多种食品保鲜等,如图所示是茶多酚中含量最高的一种儿茶素A的结构简式,关于这种儿茶素A的有关叙述正确的是( )
茶是我国的传统饮品,茶叶中含有的茶多酚可以替代食品添加剂中对人体有害的合成抗氧化剂,用于多种食品保鲜等,如图所示是茶多酚中含量最高的一种儿茶素A的结构简式,关于这种儿茶素A的有关叙述正确的是( )| A. | ②④ | B. | ①④ | C. | ②③ | D. | ③④ |
分析 有机物含有酚羟基,可发生取代、氧化和显色反应,含有醇羟基,可发生取代、消去和氧化反应,以此解答该题.
解答 解:①分子中含有5个酚羟基,可与氢氧化钠反应,含有5个酚羟基和1个醇羟基,都可与钠反应,则反应消耗金属钠和氢氧化钠的物质的量之比为6:5,故错误;
②由有机物结构简式可知分子式为C15H12O7,故正确;
③分子中酚羟基共有4个邻位后对位H原子可被取代,则1mol儿茶素A与足量的浓溴水反应,最多消耗Br2 4mol,故正确;
④分子中含有2个苯环,则1mol儿茶素A在一定条件下最多能与6ol H2加成,故错误;
故选C.
点评 本题考查有机物的结构和性质,为高考常见题型,侧重于学生的分析能力的考查,注意把握有机物的结构和官能团的性质为解答该类题目的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
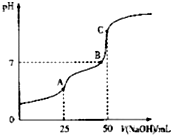 25°C时,向25ml 0.1wol•L-1 H2C2O4溶液中滴加同浓度的NaOH溶液,混合溶液的pH随滴加NaOH溶液体积的变化如图所示.下列有关叙述错误的是( )
25°C时,向25ml 0.1wol•L-1 H2C2O4溶液中滴加同浓度的NaOH溶液,混合溶液的pH随滴加NaOH溶液体积的变化如图所示.下列有关叙述错误的是( )| A. | HC2O4-的电离程度大于其水解程度 | |
| B. | B点时溶液中含有NaHC2O4和Na2C2O4 | |
| C. | A点时,c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) | |
| D. | C点时,c(Na+)>c(C2O42-)>c(HC2O4-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑧⑨ | B. | ①②③⑥⑦⑨ | C. | ①②③④⑥⑦⑨⑩ | D. | ①②③④⑥⑦⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用磁铁可以将Fe与Fe3O4分离 | |
| B. | 将生成的气体在空气中冷却可获得钠 | |
| C. | 该反应条件下铁的氧化性比钠强 | |
| D. | 每生成1molH2,转移的电子数约为4×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 苯(甲苯) | 酸性高锰酸钾溶液 NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 有关问题 |
| (1)计算所需浓硫酸的体积 | 需取浓硫酸(1.7)mL |
| (2)量 取浓硫酸 | 需要用到的主要仪器是:5mL量筒 |
| (3)将 浓硫酸沿着玻璃棒缓缓注入盛有水的烧杯中并搅拌 | 该操作要做到胆大心细,杜绝事故发生 |
| (4)待溶液冷却至室温,将烧杯中溶液转移至250mL容量瓶中 | 要注意把洗涤液一并转移至容量瓶中 |
| (5)向容量瓶中加蒸馏水至刻度线 | 在进行此操作时当加水至刻度线1-2cm处后的正确操作是:改用胶头滴管逐滴滴加到凹液面最低处与刻度线相切 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com