
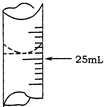
 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol?L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.11 |
| 2 | 25.00 | 1.56 | 31.30 |
| 3 | 25.00 | 0.22 | 26.31 |
| c(标准)×V(标准) |
| V(待测) |
| c(标准)×V(标准) |
| V(待测) |
| 26.11+26.31-0.22 |
| 2 |
| 0.1000mol/L×0.0261L |
| 0.025L |


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 测定序号 | 待测溶液的体积/mL | 所耗盐酸标准液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.50 |
| 2 | 20.00 | 1.20 | 21.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:

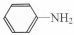 与DMC1:1发生类似反应①的反应,请写出反应方程式
与DMC1:1发生类似反应①的反应,请写出反应方程式查看答案和解析>>
科目:高中化学 来源: 题型:
 硫代硫酸钠(Na2S2O3)是常用的还原剂.在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C被完全氧化,剩余的I2用Na2S2O3标准溶液滴定,可测定溶液中维生素C的含量.发生的反应为:C6H8O6+I2═C6H6O6+2H++2I-2S2O32-+I2═S4O62-+2I-
硫代硫酸钠(Na2S2O3)是常用的还原剂.在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C被完全氧化,剩余的I2用Na2S2O3标准溶液滴定,可测定溶液中维生素C的含量.发生的反应为:C6H8O6+I2═C6H6O6+2H++2I-2S2O32-+I2═S4O62-+2I-查看答案和解析>>
科目:高中化学 来源: 题型:

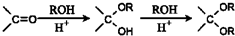
 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).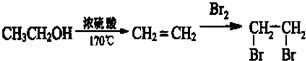
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X-、Y-、Z-、W-中Z-的还原性最强 |
| B、X2、Y2、Z2、W2中Z2的氧化性最弱 |
| C、2Z-+Y2═2Y-+Z2不能向右进行 |
| D、还原性X->Y- |
查看答案和解析>>
科目:高中化学 来源: 题型:
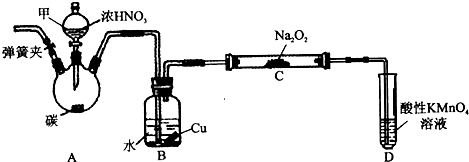
| 一系列 |
| 操作 |
| ①酸性高锰酸钾 |
| ②(NH4)2Fe(SO4)2 |
| 标准溶液滴定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com