

���� ��һ�������£�2.30g����A��5.35gNH4Cl����ǡ����ȫ��Ӧ�����ɹ���B��4.48L����C ����״����������C��������ˮ�õ�������Һ������֪CΪNH3�������ˮB������һ�ֶ�����Ԫ�صĽ�������D��������BΪ����D�Ȼ��4.48L���������ʵ���=$\frac{4.48L}{22.4L/mol}$=0.2mol��������=0.2mol��17g/mol=3.4g�����������غ��֪B������Ϊ2.3g+5.35g-3.4g=4.25g��NH4Cl��Ħ������Ϊ53.5g/mol��5.35gNH4ClΪ0.1mol����DΪ��A������������A��NH4Cl���巴Ӧ�ɱ�Ϊ��A+NH4Cl��DCl2+NH3������Clԭ���غ㣬DCl2�����ʵ���=0.05mol����Ħ������=$\frac{4.25g}{0.05mol}$=85g/mol��D����Է�������=85-71=14�����������⣬��DΪ��A������������A��NH4Cl���巴Ӧ�ɱ�Ϊ��A+NH4Cl��DCl+NH3������Clԭ���غ㣬DCl�����ʵ���=0.1mol����Ħ������=$\frac{4.25g}{0.1mol}$=42.5g/mol��D����Է�������=42.5-35.5=7����DΪLi������֪BΪLiCl����ô2.3g������A�к�LiԪ��ҲΪ 0.1mol���ٸ��������غ��ԭ���غ㣨ԭ�ӵ��������Ŀ��Ӧǰ����ͬ������2.3gA�к���Nԭ��Ϊ0.2mol-0.1mol=0.1mol������Hԭ��Ϊ0.2mol��4-0.4mol=0.2mol������֪A��LiNH2��LiNH2��Nԭ����Hԭ����Ŀ֮��Ϊ1��2��NH3��Nԭ����Hԭ����Ŀ֮��Ϊ1��3���ʻ�����E����Li��NԪ�أ�ӦΪLi3N���ݴ˴��⣮
��� �⣺��1����������ķ�����֪��A��LiNH2��
�ʴ�Ϊ��LiNH2��
��2�����ݻ�����A��LiNH2����ˮǿ��ˮ�⣬������LiOH��NH3�������������ᷴӦ����LiCl��NH4Cl����Ӧ����ʽΪ��LiNH2+2HCl=LiCl+NH4Cl��
�ʴ�Ϊ��LiNH2+2HCl=LiCl+NH4Cl��
��3����������ķ�����֪��CΪNH3��EӦΪLi3N��A��750��800��ֽ�Ϊ������E������C����Ӧ����ʽΪ��3LiNH2$\frac{\underline{\;750��800��\;}}{\;}$Li3N+2NH3���ƵõIJ����к�����������ʹ��Ʒ�����ǻ�ɫ��
�ʴ�Ϊ��3LiNH2$\frac{\underline{\;750��800��\;}}{\;}$Li3N+2NH3 ���ƵõIJ����к�����������
��4��LiNH2�ܶȴ��ڱ���ױ��Ҳ��������ǣ����Կ��ñ���ױ����и��ǣ��Ҵ��ǻ��ϵ���ϻ��ã���Ҳ���Ը�LiNH2��Ӧ������ʽΪLiNH2+C2H5OH-��C2H5OLi+NH3���������ڴ��ǻ��ϵ����ˮ���ⲻ���ã��ʴ˷�Ӧ���нϻ������ɽ��������ֲ�����Σ�գ�
�ʴ�Ϊ��LiNH2�ܶȴ��ڱ���ױ��Ҳ��������ǣ����Կ��ñ���ױ����и��ǣ��Ҵ��ǻ��ϵ���ϻ��ã���Ҳ���Ը�LiNH2��Ӧ������ʽΪLiNH2+C2H5OH-��C2H5OLi+NH3���������ڴ��ǻ��ϵ����ˮ���ⲻ���ã��ʴ˷�Ӧ���нϻ������ɽ��������ֲ�����Σ�գ�
��5��ͨ����ҵ�Ʊ�����Li������ͼ��֪���������Ҫ��LiCl��Һ���LiCl�qH2O���壬���ԣ������ӦΪ������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӣ��������Ҫ��LiCl�qH2O�����ڼ�ѹ��������Ȼ��������м��ȣ�200�棩������ˮLiCl��Ȼ����۵�����ڵ�LiCl�Ƶý���Li����
�ٲ�����еIJ��������й��ˡ�ϴ�ӣ���Ӧ�С�����Ũ������ȴ�ᾧ����
�ʴ�Ϊ������Ũ������ȴ�ᾧ��
��LiCl�qH2O������ȥ�ᾧˮ������ˮLiCl�ķ�Ӧ��LiCl�qH2O��s��?LiCl ��s��+H2O��g������һ��������������ķ�Ӧ�����Լ�Сѹǿ��������ƽ��LiCl�qH2O��s��?LiCl ��s��+H2O��g�������������ƶ�����������ˮLiCl���Ʊ���
�ʴ�Ϊ��LiCl•H2O��s��?LiCl��s��+H2O��g������Сѹǿ��������ƽ�����������ƶ�����������ˮLiCl���Ʊ���
��6��LiD����������ˮ��������������ӽ�ϣ�����������ˮ����������ӽ�ϣ���Ӧ����ʽΪ��LiD+H2O=LiOH+HD����
�ʴ�Ϊ��LiD+H2O=LiOH+HD����
���� ���⿼�������ƶϡ���ѧʵ��ȣ���Ŀ�زıȽ�İ����������Ŀ�Ѷȣ����ؿ���ѧ����֪ʶ��Ǩ��Ӧ�����ۺϷ������������������ѧ�����������нϸߵ�Ҫ�����ƶϽ���DΪLi�ǹؼ����ѶȽϴ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HCl��NaOH��Ӧ���к��ȡ�H=-57.3kJ/mol����H2SO4��Ca��OH��2��Ӧ���к��ȡ�H=2����-57.3��kJ/mol | |
| B�� | CO��g����ȼ������283.0kJ/mol����2CO2��g���T2CO��g��+O2��g����Ӧ�ġ�H=+��2��283.0��kJ/mol | |
| C�� | �����ȼ���ȡ�H=-890.3kJ•mol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪCH4��g��+2O2��g���TCO2��g��+2H2O��g����H=-890.3kJ•mol-1 | |
| D�� | Mg��CO2��ȼ������MgO��C���÷�Ӧ�л�ѧ��ȫ��ת��Ϊ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���¶��£���Ӧ��ƽ�ⳣ����$\frac{1}{64}$ | |
| B�� | 0��2min�ڣ�HI��ƽ����Ӧ����Ϊ0.1mol•L-1•min-1 | |
| C�� | �ں��������£������ϵ�г���HI���壬ƽ�ⲻ�ƶ�����Ӧ���ʲ��� | |
| D�� | �����¶ȣ�ƽ��������Ӧ�����ƶ���ֻ������Ӧ���ʼӿ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ֹ����й����ӡ�����Ǧ���ؽ���Ԫ�ض�������ˮԴ����Ⱦ | |
| B�� | �������е�ʯī�缫 | |
| C�� | ��ʹ�����й�ĵ��Һ��ʴ������Ʒ | |
| D�� | �������еĸ��ֽ��������ϰ�װ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ﵽ��ѧƽ��ʱ������ȫת��ΪNH3 | |
| B�� | �ﵽ��ѧƽ��ʱ��N2��H2��NH3�����ʵ���Ũ��һ����� | |
| C�� | �ﵽ��ѧƽ��ʱ��N2��H2��NH3�����ʵ���Ũ�Ȳ��ٱ仯 | |
| D�� | �ﵽ��ѧƽ��ʱ������Ӧ���ʺ��淴Ӧ���ʶ�Ϊ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��H=-2 878 kJ•mol-1 | B�� | ��H=-2 658 kJ•mol-1 | ||
| C�� | ��H=-1 746 kJ•mol-1 | D�� | ��H=-1 526 kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
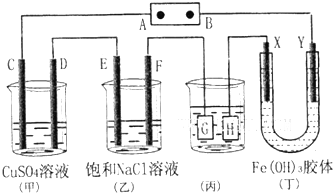
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2 mol SO2��g����1mol O2��g�����е�����֮�͵���2 mol SO3��g�����е����� | |
| B�� | ��2 mol SO2��g����1mol O2��g������һ�ܱ������г�ַ�Ӧ��ų�Q kJ������ | |
| C�� | �����¶ȣ�ƽ�����淴Ӧ�����ƶ��������Ȼ�ѧ����ʽ�е�Qֵ��С | |
| D�� | ��һ����SO2��g����O2��g������ij�ܱ������г�ַ�Ӧ�����Q kJ����˹�������2 mol SO2������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
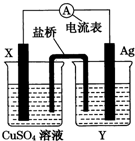 ����������ԭ��Ӧ��2Ag+��aq��+Cu��s��=Cu2+��aq��+2Ag��s����Ƶ�ԭ��أ���ͼ��ʾ����ش��������⣮
����������ԭ��Ӧ��2Ag+��aq��+Cu��s��=Cu2+��aq��+2Ag��s����Ƶ�ԭ��أ���ͼ��ʾ����ش��������⣮�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com