
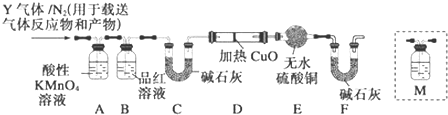
分析 [探究一](1)常温下,铁和浓硫酸发生钝化现象;
(2)①亚铁离子具有还原性,能被强氧化剂氧化,能使酸性高锰酸钾溶液褪色;
②根据SO2+Br2+2H2O═2HBr+H2SO4知,二氧化硫被氧化生成硫酸,硫酸和氯化钡反应生成硫酸钡沉淀,所以4.66g沉淀是BaSO4,根据S原子守恒得n(SO2)=n(BaSO4),进而计算SO2的体积分数;
[探究二]Q1气体,在标准状况下,密度为0.0893g•L-1.则其摩尔质量为22.4L/mol×0.0893g•L-1=2g mol/L,故Q1为氢气,Q2气体为CO2,因为碳与浓硫酸反应生成二氧化硫与二氧化碳.
二氧化硫会影响二氧化碳的检验,故应先除去二氧化硫再检验二氧化碳,由装置图可知,用酸性高锰酸钾溶液除去二氧化硫,品红溶液检验二氧化硫是否除尽,洗气瓶M中盛装澄清石灰水,为确认CO2的存在,应在B-C之间,C中碱石灰干燥气体,D中氢气与CuO发生置换反应生成Cu与水,E中无水硫酸铜检验生成水,F中碱石灰吸收水蒸气,防止空气中水蒸气加入E中.
解答 解:[探究一](1)常温下,铁和浓硫酸反应生成一层致密的氧化物薄膜而阻止进一步被氧化,该现象为钝化现象,所以将铁钉放入浓硫酸片刻无明显变化的原因是铁钉表面被钝化,
故答案为:铁钉表面被钝化;
(2)①A.氯水能将亚铁离子氧化为铁离子,但溶液中原有的铁离子和KSCN溶液反应导致溶液呈血红色,但不能确定原来溶液中一定含有亚铁离子,故错误;
B.铁粉和铁离子、酸反应生成亚铁离子,不能确定原来溶液中是否含有亚铁离子,故错误;
C..浓氨水和亚铁离子反应生成氢氧化亚铁沉淀,氢氧化亚铁能被氧化生成氢氧化铁红褐色沉淀,不能确定溶液中一定含有亚铁离子,故错误;
D.亚铁离子具有还原性,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,所以可以用酸性高锰酸钾溶液检验亚铁离子,故正确;
故选:D;
②根据SO2+Br2+2H2O═2HBr+H2SO4知,二氧化硫被氧化生成硫酸,硫酸和氯化钡反应生成硫酸钡沉淀,所以4.66g沉淀是BaSO4,n(BaSO4)=$\frac{4.66g}{233g/mol}$=0.02mol,根据S原子守恒得根据S原子守恒得n(SO2)=n(BaSO4)=0.02mol,标况下二氧化硫体积=0.02mol×22.4L/mol=0.448L=448mL,二氧化硫体积分数=$\frac{448mL}{560mL}$=680%,
故答案为:80%;
[探究二]Q1气体,在标准状况下,密度为0.0893g•L-1.则其摩尔质量为22.4L/mol×0.0893g•L-1=2g mol/L,故Q1为氢气,Q2气体为CO2,因为碳与浓硫酸反应生成二氧化硫与二氧化碳.
二氧化硫会影响二氧化碳的检验,故应先除去二氧化硫再检验二氧化碳,由装置图可知,用酸性高锰酸钾溶液除去二氧化硫,品红溶液检验二氧化硫是否除尽,洗气瓶M中盛装澄清石灰水,为确认CO2的存在,应在B-C之间,C中碱石灰干燥气体,D中氢气与CuO发生置换反应生成Cu与水,E中无水硫酸铜检验生成水,F中碱石灰吸收水蒸气,防止空气中水蒸气加入E中.
(3)品红溶液能的作用是检验SO2是否除尽,故答案为:检验SO2是否除尽;
(4)生成二氧化碳的方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(5)二氧化硫和二氧化碳都能使澄清石灰水变浑浊,所以应该在排除二氧化硫条件下将气体通入澄清石灰水中检验二氧化碳,故选:C;
(6)氢气具有还原性,在加热条件下,能将黑色的CuO还原为红色的Cu,且生成水,水能使无水硫酸铜变蓝色,所以如果Y中含有氢气,预计实验现象是D中固体由黑变红,E中固体由白变蓝,
故答案为:D中固体由黑变红,E中固体由白变蓝.
点评 本题考查探究物质组成及性质实验方案设计与评价,题目难度中等,明确实验原理及每个装置可能发生的反应及其作用为解答关键,试题培养了学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
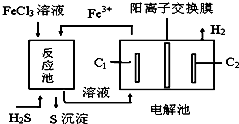
| A. | 电解池中惰性电极C1为阳极 | |
| B. | 该工艺优点之一是FeCl3溶液可循环利用 | |
| C. | 反应池中的离子方程式:2Fe3++S2-=2Fe2++S↓ | |
| D. | 电解池总反应的化学方程式:2FeCl2+2HCl$\frac{\underline{\;通电\;}}{\;}$2FeCl3+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| U | ||
| Y |
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时的甲的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:pKa=-lgKa,25℃时,H2A的pKa1=1.85,pKa2=7.19.用0.1mol•L-1 NaOH溶液滴定20mL0.1mol•L-1H2A溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )
已知:pKa=-lgKa,25℃时,H2A的pKa1=1.85,pKa2=7.19.用0.1mol•L-1 NaOH溶液滴定20mL0.1mol•L-1H2A溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )| A. | a点所得溶液中;2n(H2A)+n(A2-)=0.002mol | |
| B. | b点所得溶液中:c(H2A)+c(H+)=c(A2-)+e(OH-) | |
| C. | C点所得溶液中:c(Na+)<3c(HA-) | |
| D. | d点所得溶液中:c(Na+)>c(A2-)>c(HA-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入水中Cl2+H2O═2H++Cl-+ClO- | |
| B. | 硫化钠加入水中S2-+2H2O═H2S+2OH- | |
| C. | 冰醋酸加入水中CH3COOH+H2O?CH3COO-+H3O+ | |
| D. | 铁与水蒸气反应2Fe+3H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe2O3+3H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com