

分析 (1)计算2molN2H4反应放出的热量,可得该反应的△H,反应放热,焓变符号为“-”,单位为kJ/mol;
(2)①a.不同物质表示的正逆速率之比等于化学计量数之比,反应到达平衡;
b.平衡时c(NO2)、c(NO)浓度与二氧化氮的转化率有关;
c.随反应进行,压强增大,气体总压不变说明到达平衡;
d.平衡时各组分的含量不变;
②a.三个实验开始NO2的物质的量浓度均为1mol/L,根据n=cV计算;
b.实验Ⅱ和实验Ⅰ相比,反应速率加快,平衡时二氧化氮的浓度相等,不影响平衡移动;
c.升高温度,平衡时二氧化氮的浓度减小,说明升高温度平衡向正反应移动;
d.升高温度平衡向正反应移动,平衡常数增大;
e.计算平衡时各组分的浓度,代入平衡常数表达式K=$\frac{{c}^{2}(NO)×c({O}_{2})}{{c}^{2}(N{O}_{2})}$计算;
f.升高温度平衡向正反应移动,正反应为放热反应,△G=△H-T△S<0,反应自发进行;
③根据v=$\frac{△c}{△t}$计算v(NO2),利用速率之比等于化学计量数之比计算v(O2);
计算浓度商Qc,与平衡常数比较判断反应方向,若Qc=K,处于平衡状态,Qc<K,向正反应进行,Qc>K,向逆反应进行;
(3)利用NO2或N2O4可制备N2O5,N元素发生氧化反应,则N2O5在电解池的阳极区生成,由图可知,阳极上是 N2O4失去电子,在HNO3条件下生成N2O5,根据电荷守恒可知有H+生成.
解答 解:(1)1.00g N2H4完全反应放出19.14kJ的热量,则2molN2H4反应放出的热量为19.14kJ×$\frac{2mol×32g/mol}{1g}$=1224.96kJ,故该反应的△H=-1224.96kJ/mol,
故答案为:-1224.96;
(2)①a.由于v逆(NO2)=2v逆(O2),而v正(NO2)=2v逆(O2),则v逆(NO2)=v正(NO2),反应处于平衡状态,故a不选;
b.平衡时c(NO2)、c(NO)浓度与二氧化氮的转化率有关,平衡时浓度不一定相等,故b选;
c.随反应进行,压强增大,气体总压不变说明到达平衡,故c不选;
d.生成物NO的体积分数不变,说明反应到达平衡,故d不选,
故选:b;
②a.三个实验开始NO2的物质的量浓度均为1mol/L,开始投入的NO2的物质的量均为1mol/L×2L=2.0mol,故a错误;
b.实验Ⅱ和实验Ⅰ相比,反应速率加快,平衡时二氧化氮的浓度相等,不影响平衡移动,不能是升高温度或增大压强,实验Ⅱ可能使用了效率更高的催化剂,故b正确;
c.升高温度,平衡时二氧化氮的浓度减小,说明升高温度平衡向正反应移动,而升高温度平衡向吸热反应移动,故正反应为吸热反应,故c错误;
d.升高温度平衡向正反应移动,平衡常数增大,实验Ⅰ条件下反应的平衡常数小于实验Ⅲ条件下反应的平衡常数,故d错误;
e.800℃时,平衡时二氧化氮的浓度为0.5mol/L,则:
2NO2(g)?2NO(g)+O2(g)
起始量(mol/L):1 0 0
变化量(mol/L):0.5 0.5 0.25
平衡量(mol/L):0.5 0.5 0.25
800℃时平衡常数K=$\frac{{c}^{2}(NO)×c({O}_{2})}{{c}^{2}(N{O}_{2})}$=$\frac{0.{5}^{2}×0.25}{0.{5}^{2}}$=0.25,故e正确;
f.升高温度平衡向正反应移动,正反应为吸热反应,△H>0,正反应为熵增的反应,而△G=△H-T△S<0反应自发进行,应在高温下具有自发性,故f错误,
故选:be;
③v(NO2)=$\frac{1mol/L-0.5mol/L}{20min}$=0.025mol/(L.min),速率之比等于化学计量数之比,v(O2)=$\frac{1}{2}$v(NO2)=0.0125mol/(L.min);
浓度商Qc=$\frac{(0.5+\frac{1}{2})^{2}×(0.25+0.5)}{(0.5+\frac{1}{2})^{2}}$=0.5>K=0.25,反应向逆反应进行,
故答案为:0.0125mol/(L.min);向左;
(3)利用NO2或N2O4可制备N2O5,N元素发生氧化反应,则N2O5在电解池的阳极区生成,由图可知,阳极上是 N2O4失去电子,在HNO3条件下生成N2O5,根据电荷守恒可知有H+生成,电极反应式为:N2O4+2HNO3-2e-=2N2O5+2H+,
故答案为:阳极;N2O4+2HNO3-2e-=2N2O5+2H+.
点评 本题考查化学平衡计算、平衡状态判断、平衡常数计算与应用、反应热计算、电解原理等,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1 L 1 mol•L-1的盐酸中,含HCl分子数为NA | |
| B. | 0.1 mol Na2O2与水完全反应,转移0.2NA个电子 | |
| C. | 8.4gNaHCO3固体中含HCO3-数目为0.1 NA | |
| D. | 将含Na+数目为NA的NaCl固体溶于1 L水中,所得溶液的浓度为1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag、Cu两种单质的混合物 | B. | Cu、Fe两种单质的混合物 | ||
| C. | Ag、Fe两种单质的混合物 | D. | Ag、Cu、Fe三种单质的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
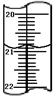 加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.
加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ①③⑦ | C. | ④⑥ | D. | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯净的铁是光亮的银白色金属 | |
| B. | 铁能被磁铁吸引,在磁场作用下,铁自身也能产生磁性 | |
| C. | 铁是地壳中含量最多的金属元素,所以分布在地壳的铁有游离态也有化合态 | |
| D. | 纯铁的抗蚀能力相当强,在干燥的空气里不易被氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com