
| A. | 硅晶体具有半导体性能,可用于制取光导纤维 | |
| B. | 二氧化硫不仅可以漂白纸浆还可用于杀菌消毒 | |
| C. | SO2、NO2或CO2都会导致酸雨的形成 | |
| D. | 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 |
分析 A.硅可作半导体材料,二氧化硅可作光导纤维材料;
B.SO2具有漂白性,也能杀菌消毒;
C.构成酸雨的主要污染物为硫和氮的氧化物,二氧化碳不会造成酸雨;
D.明矾净水是氢氧化铝净水,漂白粉的净水原理是生成的次氯酸的氧化性导致的.
解答 解:A.硅可作半导体材料,二氧化硅可作光导纤维材料,即晶体二氧化硅可用作通讯材料光导纤维,故A错误;
B.SO2具有漂白性,可以漂白纸浆,SO2能使蛋白质变性,也能杀菌消毒,故B正确;
C.SO2及氮的氧化物(主要是NO2)是造成酸雨的最主要原因,而CO2溶解形成的雨水酸性较弱,不能形成酸雨,故C错误;
D.明矾净水是铝离子水解生成的氢氧化铝具有净水作用,漂白粉的净水原理是次氯酸的氧化性而具有的净水作用,原理不一样,故D错误.
故选B.
点评 本题考查较为综合,涉及硅和二氧化硅的用途、二氧化硫的性质、净水原理等,侧重于化学与生活、环境的考查,有利于培养学生的良好的科学素养,提高学习的积极性,难度不大,注意相关基础知识的积累.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
 25℃时,有pH=2的HX溶液和HY溶液各1mL,分别加水稀释,溶液pH随溶液体积变化的曲线如图所示.下列说法正确的是( )
25℃时,有pH=2的HX溶液和HY溶液各1mL,分别加水稀释,溶液pH随溶液体积变化的曲线如图所示.下列说法正确的是( )| A. | a、c两点对应HX的电离平衡常数:K(c)>K(a) | |
| B. | a、b两点对应的溶液中:c(X-)>c(Y-) | |
| C. | 等物质的量浓度的NaX和NaY的混合溶液中:c(HY)>c(HX) | |
| D. | 分别向10 mL 0.1 mol/L HX溶液和10 mL 0.1 mol/L HY溶液中滴加同浓度的氢氧化钠溶液至pH=7,消耗氢氧化钠溶液较少的是HX |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L盐酸含有NA个HCl分子 | |
| B. | 常温常压下,22.4LCO2和SO2混合气体含有2NA个O原子 | |
| C. | 常温常压下,8gCH4含有5NA个电子 | |
| D. | 1mol/LNaCl溶液中含有NA个Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)?2NH3(g),
工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)?2NH3(g),查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16x kJ•mol-1 | B. | 8x kJ•mol-1 | C. | 4x kJ•mol-1 | D. | 2x kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
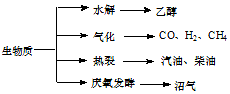 生物质资源是一种污染小的可再生能源,生物质的主要转化途径及主要产物如图.
生物质资源是一种污染小的可再生能源,生物质的主要转化途径及主要产物如图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①属于非氧化还原反应 | |
| B. | 反应②属于非氧化迩原友应 | |
| C. | 反应④中TiO2是氧化剂 | |
| D. | 反应⑤表现了金属镁还原性比进士钛强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,在pH=6的硫酸铝溶液中,由水电离出的c(OH-)=10-6mol/L | |
| B. | 浓度为0.1mol•L-1的NaHCO3溶液:c(H2CO3)>c(CO32-) | |
| C. | 25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同 | |
| D. | 向冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com