
【题目】某矿石中铁元素以氧化物FemOn形式存在,现进行如下实验:称取25.0 g样品溶于稀硫酸中,加热搅拌,滤去不溶物。向滤液中加入10.0 g铜粉充分反应后过滤、洗涤、干燥得固体3.6 g。剩下滤液用2 mol·L-1的酸性KMnO4滴定,消耗KMnO4溶液25.00 mL。
(1)该铁矿石中铁元素的质量分数为________(保留三位有效数字);
(2)氧化物FemOn的化学式中m=____,n=____(m、n为正整数)。
【答案】56.0% 5 7
【解析】
溶于稀硫酸后的滤液中加入10.0 g铜粉充分反应后过滤、洗涤、干燥得固体3.6 g,则10.0g-3.6g=6.4g铜和铁离子反应,据此可计算Fe3+物质的量;剩下滤液中铁元素全部以Fe2+存在,其物质的量可通过2 mol·L-1的酸性KMnO4滴定所消耗KMnO4溶液25.00 mL计算所得,据此计算;
(1)据分析,剩下滤液中铁元素全部以Fe2+存在,则 ,解得n(Fe2+)=0.25 mol,根据Fe守恒,剩下滤液中铁元素质量即为该铁矿石中铁元素总量,则该铁矿石中铁元素的质量分数为
,解得n(Fe2+)=0.25 mol,根据Fe守恒,剩下滤液中铁元素质量即为该铁矿石中铁元素总量,则该铁矿石中铁元素的质量分数为![]() = 56.0% ;
= 56.0% ;
答案为:56.0% ;
(2) 25.0 g样品溶于稀硫酸中,且6.4g铜和其中的铁离子发生反应:![]() ,则n(Fe3+)=2n(Cu)=2×
,则n(Fe3+)=2n(Cu)=2×![]() =0.2mol,则25.0 g样品溶于稀硫酸所得溶液中含有Fe2+为0.25 mol-0.2mol=0.05mol,则亚铁离子和铁离子的物质的量之比为0.05mol:0.2mol=1:4,故氧化物可表示为:FeO·2Fe2O3,即氧化物为Fe5O7,则m=5,n=7;
=0.2mol,则25.0 g样品溶于稀硫酸所得溶液中含有Fe2+为0.25 mol-0.2mol=0.05mol,则亚铁离子和铁离子的物质的量之比为0.05mol:0.2mol=1:4,故氧化物可表示为:FeO·2Fe2O3,即氧化物为Fe5O7,则m=5,n=7;
答案为:5;7。


科目:高中化学 来源: 题型:
【题目】X.Y、Z、W四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是

A. 四种元素的原子半径由小到大的顺序为:r(X)<r(Z)<r(W)<r(Y)
B. X、Y、Z既能形成离子化合物,又能形成共价化合物
C. X与其余三种元素之间形成的核外电子总数为10的微粒只有2种
D. H2Z的熔点比HW高,是因为它们的晶体类型不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组设计实验制取氨气并探究氨气的有关性质:
(1)实验室制备氨气,下列方法中适宜选用的是 ___________(填编号)
A . 氯化铵溶液与氢氧化钠溶液共热
B. 固体氢氧化钠中滴加浓氨水
C. 固态氯化铵加热分解
D. 固态硝酸铵加热分解
E. 固态氯化铵与熟石灰混合加热
(2)该小组成员设计实验制备氨气并探究氨气的还原性及产物,提供实验装置如图:
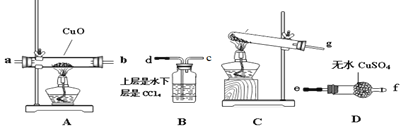
①装置C中发生反应的化学方程式为______________
②根据上述提供的装置正确的连接顺序为____________(用各接口序号表示)
③该装置在设计上有一定的缺陷,你对该装置的改进措施是___________。
(3)利用改进后的装置进行实验,观察到CuO全部变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体。请写出NH3与CuO反应的化学方程式________
(4)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。请你设计一个简单的实验检验该红色物质中是否含有Cu2O__________。已知:Cu2O+2H+=Cu+Cu2+ +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24 L H2O中含有的原子数目为0.3NA
B.常温常压下,4.6 g NO2与N2O4混合气体中含有的氧原子数目为0.2 NA
C.0.1 molL-1 K2CO3溶液中含有的钾离子数目为0.2NA
D.0.lmol铁与足量氯气反应时,转移的电子数目为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液A可能含有Na+、NH4+、Mg2+、Fe3+、Ba2+、Clˉ、SO42-、Iˉ、CO32-、HCO3-离子中的若干种。取该溶液进行如下实验:(已知Ag2SO4微溶于水,可溶于硝酸):

下列说法正确的是
A.溶液A中一定没有Ba2+,可能存在SO42-
B.白色沉淀甲一定为Mg(OH)2
C.溶液A中一定存在NH4+、Clˉ,一定不存在Fe3+、Iˉ、CO32-
D.判断溶液A中是否存在Fe3+,需向溶液A中加入KSCN溶液观察溶液是否变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝生产加工过程中产生大量的铝灰,直接掩埋造成铝资源浪费,还会带来严重的污染。某铝厂的铝灰经分析所含主要物质如下:Al、Al2O3、AlN、SiO2、Fe2O3,其他杂质均不溶于稀硫酸。如图是酸浸法用该铝灰生产高纯氧化铝的生产流程:
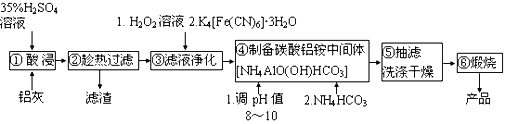
已知:i.Fe3+ +K++ [Fe(CN)6]4-=K[Fe(CN)6Fe]↓
ii.AlN常温下与水缓慢反应,酸性或碱性条件下反应较快
iii.NH4AlO(OH)HCO3难溶于碱性溶液和乙醇
请回答:
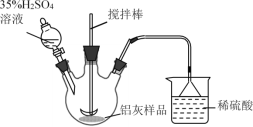
(1)实验室模拟工业生产①酸浸步骤的装置如图,该装置的不合理之处为____。
(2)步骤③加入H2O2溶液的目的是________________。
(3)步骤④调节pH最合适的试剂是________________。
A.NaOH B.H2SO4 C.NH3·H2O D.Ca(OH)2
(4)步骤⑤吸滤瓶内液体高度快达到支管口位置时应拔掉瓶上橡皮管,_______,洗涤沉淀操作为_______________。
(5)写出煅烧碳酸铝铵中间体得到高纯氧化铝的化学方程式______________。
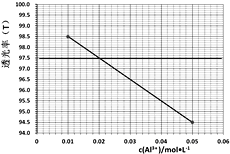
(6)已知Al3+对光的吸收与其浓度成线性关系,色度计传感器可以测量某种波长的光穿过溶液的透射率确定溶液浓度。如图是红色光照下透光率(T)对应c(Al3+)的标准曲线。为测定铝灰中铝元素的回收率,准确称取0.5000g铝灰(折合铝元素含量60.00%)进行制备高纯氧化铝的实验,将所制得的粉末与固体NaOH反应后加水溶解、过滤,滤液定容到250mL容量瓶中。用移液管移取25.00mL到锥形瓶中,加2滴指示剂,滴加稀盐酸至溶液体积变为50.00mL,NaAlO2恰好反应生成AlCl3。取该溶液于比色皿中进行色度检测,测得溶液透光率为97.5,则铝元素的回收率=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“ ZEBRA”绿色电池是新型电动汽车的理想电源,结构如图所示:隔开两极的陶瓷管作钠离子导体。下列关于该电池的叙述错误的是

A. 放电时,Na+、Al3+均向负极移动
B. 放电时,Na元素被氧化
C. 充电时的阳极反应为:Ni+2C1--2e—=NiCl2
D. 该电池具有可快充、高比功率、放电持久等优点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国制碱专家侯德榜先生潜心研究制碱技术,发明了侯氏制碱法。工业上以侯氏制碱法为基础生产焦亚硫酸钠(Na2S2O5)的工艺流程如下:
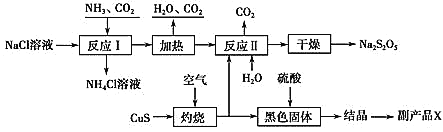
已知:反应Ⅱ包含2NaHSO3Na2S2O5+H2O等多步反应。
(1) 反应Ⅰ的化学方程式为________;在进行反应Ⅰ时,向NaCl溶液中先通入_______(填“CO2”或“NH3”);
(2)“灼烧”时发生反应的化学方程式为__________;
(3)已知Na2S2O5与稀硫酸反应放SO2,其离子方程式为__________。
(4)副产品X化学式为________;生产中可循环利用的物质为____________(化学式)。
(5)为了减少产品Na2S2O5中的杂质含量,理论上需控制反应Ⅱ中气体与固体反应物的物质的量之比为_________,若气体量不足,则会导致___________________,检验产品中是否含有碳酸钠杂质,所需试剂是_________(填编号)。
①酸性高锰酸钾溶液 ②品红溶液 ③澄清石灰水 ④饱和碳酸氢钠溶液 ⑤NaOH溶液 ⑥稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现需设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积(约 6 mL)和检验氯气的氧化性(不应将多余的氯气排入空气中)。
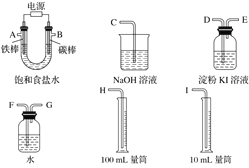
(1)试从下图中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是 A 接_____,_____接_____; B 接_____,_____接_____。
(2)铁棒接直流电源的_____极;碳棒上发生的电极反应为_____。
(3)能说明氯气具有氧化性的实验现象是_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com