
| A. | 2C1>C2 | B. | 2C1=C2 | C. | 2C1<C2 | D. | 无法计算 |
分析 先利用c=$\frac{1000ρω}{M}$计算质量分数为a%、2a%的氢氧化钾溶液的物质的量浓度,再根据氢氧化钾溶液的浓度越大密度也越大进行讨论.
解答 解:设将溶质质量分数为a%的KOH溶液密度为ρ1,
则C1=$\frac{1000{ρ}_{1}×a%}{56}$mol/L=$\frac{10a{ρ}_{1}}{56}$mol/L,
设将溶质质量分数为2a%的KOH溶液密度为ρ2,
则C2=$\frac{1000{ρ}_{2}2a%}{56}$mol/L=$\frac{20a{ρ}_{2}}{56}$mol/L,
所以C1:C2=$\frac{10a{ρ}_{1}}{56}$mol/L:$\frac{20a{ρ}_{2}}{56}$mol/L=ρ1:2ρ2,
即C2=$\frac{2{ρ}_{2}}{{ρ}_{1}}$C1
KOH溶液的浓度越大密度也越大,所以ρ2>ρ1,所以$\frac{2{ρ}_{2}}{{ρ}_{1}}$>2,
所以C2>2C1,即:2C1<C2,
故选C.
点评 本题考查物质的量浓度与质量分数的相互换算,题目难度中等,明确氢氧化钾溶液密度与质量分数的关系为解答关键,注意掌握物质的量浓度与溶质质量分数的转化关系,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:解答题
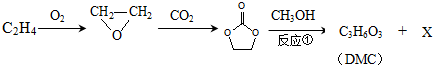
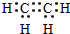 ;石油工业上获得C2H4的操作名称为:石油裂解
;石油工业上获得C2H4的操作名称为:石油裂解

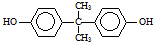 )在一定条件下可生成芳香族聚碳酸酯,写出反应的化学方程式:
)在一定条件下可生成芳香族聚碳酸酯,写出反应的化学方程式: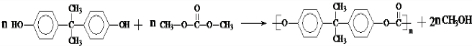 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
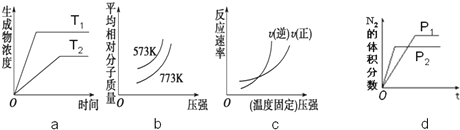
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向久置的氯水中滴入紫色石蕊试液,溶液将先变红后褪色 | |
| B. | 欲除去Cl2中少量HCl气体,可将此混合气体通过盛饱和食盐水的洗气瓶 | |
| C. | 漂白粉有效成分是CaCl2和Ca(ClO)2,应密闭保存 | |
| D. | Cl2与水反应生成盐酸和次氯酸的离子方程式为:Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量CO2通入漂白液中:CO2+ClO-+H2O═HClO+HCO3- | |
| B. | 向含K+、CO32-、OH-的溶液中通入少量CO2:2OH-+CO2═CO32-+H2O | |
| C. | 强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3═FeO42-+3Cl-+H2O+4H+ | |
| D. | 3molCl2通入含4molFeI2的溶液中充分反应:2I-+Cl2═I2+2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酒精萃取碘水中的碘 | |
| B. | 蒸馏操作时,温度计的水银球要插入溶液中 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 用分液漏斗分离水和四氯化碳时,水从上口倒出,四氯化碳从下口放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HC的电离度最大 | |
| B. | HA溶液酸性最强 | |
| C. | HC溶液酸性最强 | |
| D. | 三种溶液中酸的电离程度:HA<HB<HC |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
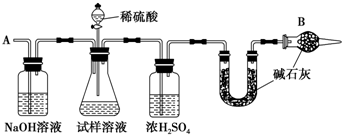
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com