
有机物A常用作烟道气的警告剂,也可以做橡胶硫化促进剂、鞣剂等。一定条件下它可发生下图转化。已知E为高分子化合物。
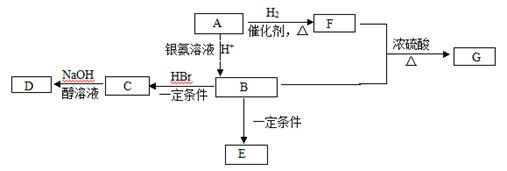
(1) 7.0 g有机物A完全燃烧可产生0.4 mol CO2和5.4 g H2O,经测定A分子含有甲基,所有的碳原子在一条碳链上,其蒸气对氢气的相对密度是35,A的结构简式为 。
(2)F中所含官能团的名称是 ,具有此官能团的F的同分异构体的数目有 种。
(3)B→C的反应类型为 ,C→D的反应类型为 。
(4)写出F+B→G的化学方程式 。
(5)下列关于B的说法正确的是 (填字母)。
A.不能使酸性高锰酸钾溶液褪色
B.可以与金属钠生成氢气
C.可以与碳酸钠反应
D.所有的原子都在同一平面上
【答案】(1) CH3CH = CHCHO (2)羟基 4种 (3加成反应 消去反应
(4)CH3CH = CHCOOH+CH3CH2CH2CH2OH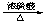 CH3CH = CHCOOCH2CH2CH2CH3+ H2O
CH3CH = CHCOOCH2CH2CH2CH3+ H2O
(5)BC
【解析】本题突破口在A,由(1)可得:A蒸气对氢气的相对密度是35,B的分子量为70。7.0 g有机物A完全燃烧可产生0.4 mol CO2和5.4 g H2O,即0.1 mol A可产生0.4 mol CO2和0.3 mol H2O,0.4 mol CO2含C的质量为4.8 g,0.3 mol H2O含H的质量为0.6 g,此有机物含有O,O的质量为7.0 g -4.8 g -0.6 g = 1.6 g,即0.1 mol O,A的分子式为C4H6O,A分子中含有甲基,而A中含有醛基、碳碳双键、有的碳原子在一条碳链上,所以A为CH3CH = CHCHO。


 小学教材全测系列答案
小学教材全测系列答案科目:高中化学 来源: 题型:
下列说法正确的是( )
①中心原子采取sp3杂化的分子,其立体构形一定是正四面体;②分子晶体的熔点一定比金属晶体的低;③分子间作用力越大,分子越稳定;④离子晶体中,一定存在离子键;⑤非极性分子中一定含有非极性键;⑥ 原子晶体中,一定存在共价键;⑦固态不导电,熔融时能导电的晶体一定是离子晶体
A.①② ④ B.④⑤ ⑥ C.④ ⑥ ⑦ D.③ ④ ⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
经测定,某有机物含碳77.8%、氢7.4%、氧14.8%;又测得此有机物的蒸气对相同条件下同体积的氢气质量比为54:1,求此有机物的分子式。若此有机物能与烧碱反应,且苯环上的一溴代物只有二种,试写出它的结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E是短周期中原子序数依次增大的5种元素,其中A与B形成可使红色石蕊试纸变蓝的气体,A与C可形成化学式为A2C,A2C2的化合物,D的最高价氧化物对应水化物呈强碱性,B与E可形成三角锥型分子且每个原子最外层都满足8电子稳定结构,则下列说法正确的是 ( )
A.离子半径:D+>E->C2->A+
B、A与B形成的物质,每个原子最外层都满足稀有气体稳定结构的分子只有BA3
C.C、D、E形成的化合物溶于水可呈弱碱性
D.B、C的简单氢化物形成的化合物前者稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中的一定量混合气体发生反应: xA(g)+yB(g) zC(g),平衡时测得A的浓度0.50mol/L,保持温度不变,将容器的容积大到原来的两倍,再达平衡时,测得A的浓度降低为0.30mol/L。下列有关判断错误的是()
zC(g),平衡时测得A的浓度0.50mol/L,保持温度不变,将容器的容积大到原来的两倍,再达平衡时,测得A的浓度降低为0.30mol/L。下列有关判断错误的是()
A.x+y<z B.平衡向逆反应方向移动 C.B的转化率降低 D.C的体积分数下降
查看答案和解析>>
科目:高中化学 来源: 题型:
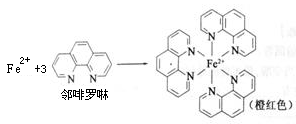
元素周期表中第四周期的金属元素在生产和科研中有非常重要的使用价值。
(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉作显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰。相关的反应如下:4FeCl3+2NH2OH·HCl=4FeCl2+N2O+6HCl+H2O
①Fe3+在基态时,核外电子排布式 。
 ②羟胺(NH2OH)中O采用 杂化。
②羟胺(NH2OH)中O采用 杂化。
③Fe2+与邻啡罗啉形成的配合物中,配体数为 。
(2)向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中析出深蓝色的晶体[Cu(NH3)4]SO4·H2O,该晶体中含有的化学键类型是 。
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+,已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是 。
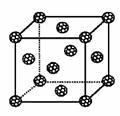
(4)现把C60抽象成质点,该晶体的晶胞结构如右图所示,如果把晶胞顶点与最近三个面心所围成的空隙叫做四面体空隙,第四周期电负性最小的原子可作为容体掺入C60晶体的空隙中,形成具有良好的超导性的掺杂C60化合物。若每个四面体空隙填入一个原子,则全部填满C60晶体的四面体空隙后,所形成的掺杂C60化合物的化学式为 。若C60的半径为apm,则掺杂C60化合物密度为 g/cm3。(阿伏加德罗常数用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:(1)Zn(s)+1/2O2(g)=ZnO(s);△H=-348.3 kJ/mol;
(2)2Ag(s)+1/2O2(g)=Ag2O(s);△H=-31.0 kJ/mol。则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H等于:
A.-317.3 kJ/mol B.-379.3 kJ/mol
C.-332.8 kJ/mol D.317.3 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com