科学研究、工业生产和日常生活都离不开物质的制备.
(一)N
2O
5是一种新型硝化剂,其性质和制备受到人们的关注.
(1)N
2O
5与苯发生硝化反应生成的硝基苯的结构简式为
.
(2)一定温度下,在恒容密闭容器中N
2O
5可发生下列反应:2N
2O
5(g)?4NO
2(g)+O
2(g)△H>0
①反应达到平衡后,若再通入一定量氮气,则N
2O
5的转化率将
(填“增大”、“减小”或“不变”).
②下表为反应在T
1温度下的部分实验数据:
| t/s |
0 |
500 |
1000 |
| c(N2O5/mol?L-1) |
5.00 |
3.52 |
2.48 |
则500s内N
2O
5的分解速率为
.
③在T
2温度下,反应1000s时测得N
2O
5的浓度为4.98mol/L,则T
2
T
1(填“>“、“<”或“=”).
(3)图1所示装置可用于制备N
2O
5,生成N
2O
5的电极反应式为
.

(二)工业上制备BaCl
2的工艺流程图如图2,某研究小组在实验室用重晶石(主要成分为BaSO
4)对上述工业过程进行了模拟实验.
(1)步骤①中BaSO
4与碳在高温下反应,每1mol碳生成CO需要吸收142.8kJ的热量,此反应的热化学方程式为
.
(2)向BaCl
2溶液中加入AgNO
3和KBr,当两种沉淀共存时,
=
.
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10](3)若用含8.0gNaOH的溶液吸收H
2S气体,将得到的溶液小心蒸干,得到无水物7.9g,则该无水物一定含有的成分是
.若NaOH溶液吸收H
2S气体生成等物质的量的Na
2S和NaHS,则溶液中各离子浓度由大到小的顺序为
.


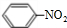 ,
,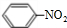 ;
;

