
| A. | 将过量CO2气体通入水玻璃中可制得硅酸和纯碱 | |
| B. | 标准状况下,2.24LCl2与过量稀NaOH溶液反应,转移电子0.1mol | |
| C. | 1L2mol•L-1明矾经水解可得到氢氧化铝胶体粒子数目为2×6.02×1023 | |
| D. | 漂白粉溶于水能导电,故漂白粉是电解质 |
分析 A、过量CO2气体与硅酸钠溶液生成碳酸氢钠;
B、与氢氧化钠反应时既作氧化剂又作还原剂;
C、水解时可逆的,不可能完全转化;
D、漂白粉是次氯酸钙与氯化钙的混合物.
解答 解:A、过量CO2气体与硅酸钠溶液生成碳酸氢钠,而不是碳酸钠,故A错误;
B、标准状况下2.24L的氯气的物质的量是0.1mol,与氢氧化钠反应时既作氧化剂又作还原剂,所以转移电子0.1mol,故B正确;
C、水解时可逆的,所以1L2mol•L-1明矾经水解可得到氢氧化铝胶体粒子数目小于2×6.02×1023,故C错误;
D、电解质属于化合物,而漂白粉是次氯酸钙与氯化钙的混合物,不是电解质,故D错误;
故选B.
点评 本题考查二氧化碳与硅酸钠溶液的反应,氧化还原反应中电子的转移数目,盐的水解,电解质的概念.


科目:高中化学 来源: 题型:解答题

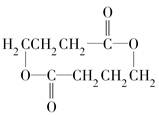 ;
;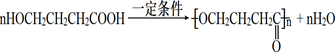 或
或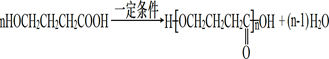 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:Al3+、Cl-、MnO4-、SO42- | |
| B. | 含有大量Fe3+的溶液中:Na+、Mg2+、NO3-、SCN- | |
| C. | 加入铝粉能产生氢气的溶液中:CH3COO-、NH4+、SO42-、I- | |
| D. | 使酚酞变红色的溶液:CO32-、Cl-、F-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴极:2H++2e-═H2↑ 阳极:4OH--4e-═O2↑+2H2O | |
| B. | 阴极:Cu2++2e-═Cu 阳极:4OH--4e-═O2↑+2H2O | |
| C. | 阴极:2H++2e-═H2↑ 阳极:2C1--2e-═Cl2↑ | |
| D. | 阴极:Cu2++2e-═Cu 阳极:2C1--2e-═Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
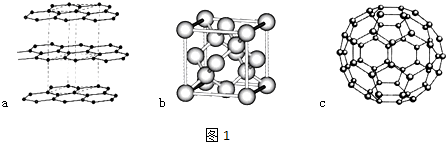
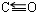 ;写出另一与CO互为等电子体的化学式CN-.
;写出另一与CO互为等电子体的化学式CN-.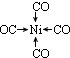 ;写出基态Ni原子的电子排布式1s22s22p63s23p63d84s2.
;写出基态Ni原子的电子排布式1s22s22p63s23p63d84s2.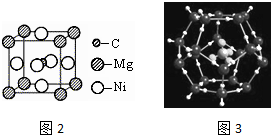
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
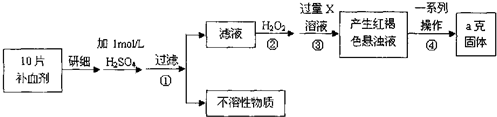
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (已知乙醇的键线式为
(已知乙醇的键线式为 )
)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com