
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 3种 |
分析 先书写戊基-C5H11异构体,戊基异构数目等于戊醇的异构体数目,分子式为C5H12O的醇,能被酸性KMnO4溶液氧化成C5H10O,则与羟基所连碳上只含有1个氢原子,以此确定醇的结构简式.
解答 解:戊基-C5H11可能的结构有8种:-CH2CH2CH2CH2CH3、-CH(CH3)CH2CH2CH3、-CH(CH2CH3)2、-CHCH(CH3)CH2CH3、-C(CH3)2CH2CH3、-CH(CH3)CH(CH3)2、-CH2CH2CH(CH3)2、-CH2C(CH3)3,戊基异构数目等于戊醇的异构体数目,分子式为C5H12O的醇有8种结构,其中能被酸性KMnO4溶液氧化成C5H10O,则与羟基所连碳上只含有1个氢原子,符合此条件的醇的同分异构体(不考虑立体异构)最多有4种:HOCH(CH3)CH2CH2CH3、HOCH(CH2CH3)2、HOCHCH(CH3)CH2CH3、HOCH(CH3)CH(CH3)2,故选A.
点评 本题考查有机物的推断、同分异构体的书写等,难度中等,可以利用烃基异构判断.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol任何物质都含有6.02×1023个分子 | |
| B. | 在相同条件下,相同物质的量CO、N2的混合气体与O2的分子个数相同,原子个数也相同 | |
| C. | NaOH的摩尔质量40g | |
| D. | 在标准状况下,1molO2与1molSO3的体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
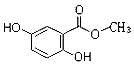
 .
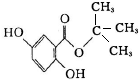
.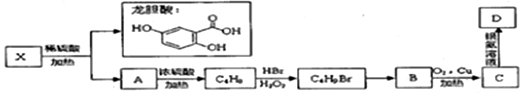
 ,C4H9Br→B的化学反应是取代反应.
,C4H9Br→B的化学反应是取代反应. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
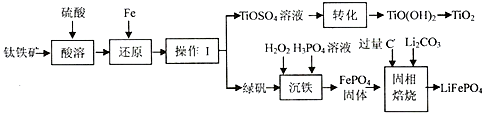
| 温度(℃) | 30 | 20 | l5 | l0 | 5 | 0 | -2 | -6 |
| FeSO4(g/L) | 240 | 190 | 130 | 117 | 95 | 79 | 59 | 38 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
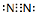 .下列能实现人工固氮的是D.
.下列能实现人工固氮的是D.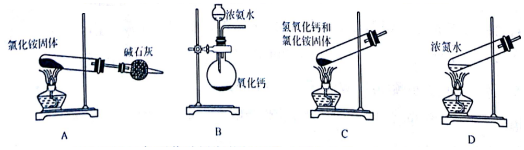
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将乙烯和乙炔气体分别通入溴的四氯化碳溶液中,两者都褪色 | |
| B. | 甲烷和氯气在室温下的光照环境中可以稳定存在 | |
| C. | 苯能使溴水褪色是因为二者反应生成了溴苯 | |
| D. | 要除去乙烷中的乙烯制得纯净的乙烷,将混合气体通入酸性高锰酸钾溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Al(OH)3 | Ga(OH)3 | |
| 酸式电离常数Ka | 2×10-11 | 1×10-2 |
| 碱式电离常数Kb | 1.3×10-33 | 1.4×10-34 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
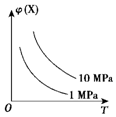
| A. | N2(g)+3H2(g)?2NH3(g)△H<0 | B. | 2HI(g)?H2(g)+I2(g)△H>0 | ||
| C. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 | D. | C(s)+H2O(g)?H2(g)+CO(g)△H>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com