
| A. | 42 | B. | 39 | C. | 31 | D. | 28 |
科目:高中化学 来源: 题型:解答题
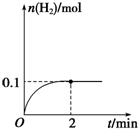 一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI?H2+I2,H2物质的量随时间的变化如图所示.
一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI?H2+I2,H2物质的量随时间的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X中含有碳碳双键 | B. | X中含有一个羧基和两个羟基 | ||
| C. | X中含有两个羧基和一个羟基 | D. | X中含有三个羟基和一个-COOR |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用浓硝酸与Cu反应制取NO2 | B. | 用浓盐酸和MnO2反应制取Cl2 | ||
| C. | 用H2O2溶液和MnO2反应制取O2 | D. | 用NH4Cl和Ca(OH)2反应制取NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2NCONH2与H2O2是通过氢键结合的 | B. | H2O2分子中只含σ键,不含π键 | ||
| C. | H2O2既有氧化性又有还原性 | D. | H2NCONH2•H2O2属于离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.45 mol/(L•s) | B. | 0.15 mol/(L•s) | C. | 0.225 mol/(L•s) | D. | 0.9 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | c | d | |||||
| 3 | a | b | e | f |
| A. | e的氢化物比d的氢化物稳定 | |
| B. | a、b、e三种元素的原子半径:e>b>a | |
| C. | 六种元素中,c元素单质的化学性质最活泼 | |
| D. | c、e、f的最高价氧化物对应的水化物的酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 验证乙炔能被酸性高锰酸 钾溶液氧化 | 将电石与饱和食盐水反应生成的气体通入酸性 高锰酸钾溶液,观察溶液是否褪色 |
| B | 验证苯和液溴在FeBr3的 催化下发生取代反应 | 将反应产生的混合气体通入AgNO3溶液上方, 观察是否有淡黄色沉淀生成 |
| C | 除去乙酸乙酯中混有的少 量乙酸 | 加入足量饱和Na2CO3溶液,振荡,静置,分液, 取出上层液体 |
| D | 检验溴乙烷中的溴元素 | 取少量溴乙烷,与氢氧化钠溶液共热后加入硝 酸银溶液,观察是否出现淡黄色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com