

分析 图象分析可知,3min后反应物和生成物的浓度不再随时间变化,说明反应达到平衡状态,根据AB的浓度变化结合反应方程式计算A2的浓度变化,从而得出a值.
解答 解:图象分析可知,3min后反应物和生成物的浓度不再随时间变化,说明反应达到平衡状态,该反应进行到3min,反应达到平衡状态,当AB的浓度改变0.5 mol•L-1,由方程式A2(g)+B2(g)?2AB(g)知,A2的浓度改变为0.25mol•L-1,所以a=(0.4-0.25)mol•L-1=0.15mol•L-1,即图中a点的值为0.15,
故答案为:3;0.15.
点评 本题考查化学反应速率、化学平衡的有关计算、平衡图象的分析,难度较简单,掌握基础是关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
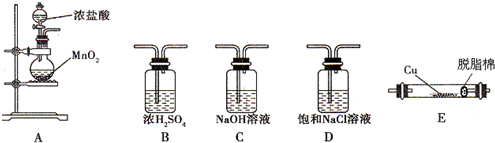
 ;若在标准状态下收集到2.24L氯气,则被氧化的HCl的物质的量是0.2mol.
;若在标准状态下收集到2.24L氯气,则被氧化的HCl的物质的量是0.2mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 从“南澳一号”沉船中发现了大量宋代精美瓷器,体现了灿烂的中华文明.青花瓷胎体的原料--高岭土[Al2Si2O5(OH)x]可掺进瓷石制胎,青花瓷釉料的成分主要是钾长石(KAlSi3O8),在1 300℃左右一次烧成的釉可形成精美的青花瓷.
从“南澳一号”沉船中发现了大量宋代精美瓷器,体现了灿烂的中华文明.青花瓷胎体的原料--高岭土[Al2Si2O5(OH)x]可掺进瓷石制胎,青花瓷釉料的成分主要是钾长石(KAlSi3O8),在1 300℃左右一次烧成的釉可形成精美的青花瓷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的转化率是60% | B. | 该反应的平衡常数 是12.5 | ||
| C. | 平衡时总物质的量是2.6mol | D. | 平衡时气体的密度是15.6g/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知一定温度和压强下,在起始容积为V L的容器中充入1mol A和1mol B,保持恒温恒压下反应:A(g)+B(g)?C(g)△H>0.达到平衡时,C的体积分数为40%.试回答:
已知一定温度和压强下,在起始容积为V L的容器中充入1mol A和1mol B,保持恒温恒压下反应:A(g)+B(g)?C(g)△H>0.达到平衡时,C的体积分数为40%.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和NaOH反应的中和热△H=-57.3kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)═2CO(g)+O2(g)反应的△H=+2×283.0 kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g);△H12C(s)+O2(g)=2CO(g);△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用甲除去CO气体中的CO2气体 | |
| B. | 用乙分离沸点相差较大的互溶液体混合物 | |
| C. | 丙向容量瓶中转移液体 | |
| D. | 用丁分离互不相溶的两种液体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com