
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
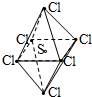 SCl6是一种无色的很稳定的物质,可用于灭火.SCl6的分子结构如图所示,呈正八面体型.如果氯元素有两种稳定的同位素,则SCl6的不同的分子种数为( )
SCl6是一种无色的很稳定的物质,可用于灭火.SCl6的分子结构如图所示,呈正八面体型.如果氯元素有两种稳定的同位素,则SCl6的不同的分子种数为( )| A、6 | B、7 | C、10 | D、12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 现象 |
| a.用干燥洁净的烧杯取约10mL浓硝酸,加热. | / |
| b.把小块烧红的木炭迅速伸入热的浓硝酸中. | 红热的木炭与热的浓硝酸接触发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧,发出光亮. |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(CH3COO-) |
| c(CH3COOH)?c(OH-) |
| c(CH3COOH) |
| c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com