
【题目】某同学用软锰矿(主要含MnO2,还含有少了SiO2、Al2O3 、Fe2O3等杂质)模拟工业制高锰酸钾流程如下。试回答下列问题。

(1)配平焙烧时MnO2参与的化学反应:□MnO2+□_____+□O2 ![]() □K2MnO4+□H2O;第二次通入过量CO2时发生反应的离子方程式为:______________________。
□K2MnO4+□H2O;第二次通入过量CO2时发生反应的离子方程式为:______________________。
(2)滤渣I、II的成分中能与NaOH 反应的是__________________ (填化学式)。产生滤渣II时不能用稀盐酸代替CO2,因为______________________。
(3)将滤液Ⅲ进行一系列操作可得到KMnO4晶体。由下图可知,从滤液Ⅲ得到KMnO4需经过____、____洗涤等操作。

(4)用重结晶提纯的产品配制成0.10mol·L-1 的酸性KMnO4溶液来测定某草酸样品的纯度(杂质不参与反应,草酸为弱酸,分子式H2C2O4)。
①试给出反应的离子方程式:_______________________。
②若某测定大致共需要230毫升酸性KMnO4溶液,配制时所需玻璃仪器为:___、___烧杯、胶头滴管等。
③取草酸样品5 克,配成100mL溶液,取20mL于适当容器中,用前述所配酸性KMnO4溶液滴定,至反应结束消耗KMnO4溶液20mL,则样品的纯度为: ___________。
【答案】 2MnO2+4KOH+O2![]() 2K2MnO4+2H2O 3MnO42-+4CO2+2H2O=MnO2+2MnO4-+4HCO3- H2SiO3、Al(OH)3 盐酸会溶解Al(OH)3,使Al3+进入滤液产生杂质 蒸发结晶 趁热过滤 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2+8H2O 250mL容量瓶 玻璃棒 45%
2K2MnO4+2H2O 3MnO42-+4CO2+2H2O=MnO2+2MnO4-+4HCO3- H2SiO3、Al(OH)3 盐酸会溶解Al(OH)3,使Al3+进入滤液产生杂质 蒸发结晶 趁热过滤 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2+8H2O 250mL容量瓶 玻璃棒 45%
【解析】在加热以及空气的作用下二氧化锰与氢氧化钾反应生成锰酸钾和,二氧化硅、氧化铝也均与氢氧化钾反应生成偏铝酸钾和硅酸钾,氧化铁不反应,所得固体物质用水溶解后得到滤渣Ⅰ是氧化铁;滤液Ⅰ中通入二氧化碳生成氢氧化铝和硅酸沉淀,即滤渣Ⅱ是氢氧化铝和硅酸;滤液Ⅱ中通入二氧化碳后锰酸钾发生自身的氧化还原反应生成二氧化锰和高锰酸钾,则
(1)反应中Mn元素从+4价升高到+6价,失去2个电子,1分子氧气得到4个电子,根据电子得失守恒以及原子守恒可知配平后的方程式为2MnO2+4KOH+O2![]() 2K2MnO4+2H2O;根据以上分析可知第二次通入过量CO2时发生反应的离子方程式为3MnO42-+4CO2+2H2O=MnO2+2MnO4-+4HCO3-。(2)滤渣I、II的成分中能与NaOH反应的是H2SiO3、Al(OH)3。由于盐酸是强酸,会溶解Al(OH)3,使Al3+进入滤液产生杂质,因此产生滤渣II时不能用稀盐酸代替CO2。(3)由下图可知碳酸氢钾的溶解度受温度影响大于高锰酸钾,所以从滤液Ⅲ得到KMnO4需经过蒸发结晶、趁热过滤、洗涤等操作。(4)①反应中Mn元素化合价从+7价降低到+2价,得到5个电子,碳元素化合价从+3价升高到+4价,失去1个电子,所以根据电子得失守恒、原子守恒以及电荷守恒可知反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。②没有230mL容量瓶,则配制时所需玻璃仪器为250mL容量瓶、玻璃棒、烧杯、胶头滴管等。③消耗高锰酸钾是0.002mol,根据方程式可知参加反应的草酸是0.005mol,因此样品的纯度为
2K2MnO4+2H2O;根据以上分析可知第二次通入过量CO2时发生反应的离子方程式为3MnO42-+4CO2+2H2O=MnO2+2MnO4-+4HCO3-。(2)滤渣I、II的成分中能与NaOH反应的是H2SiO3、Al(OH)3。由于盐酸是强酸,会溶解Al(OH)3,使Al3+进入滤液产生杂质,因此产生滤渣II时不能用稀盐酸代替CO2。(3)由下图可知碳酸氢钾的溶解度受温度影响大于高锰酸钾,所以从滤液Ⅲ得到KMnO4需经过蒸发结晶、趁热过滤、洗涤等操作。(4)①反应中Mn元素化合价从+7价降低到+2价,得到5个电子,碳元素化合价从+3价升高到+4价,失去1个电子,所以根据电子得失守恒、原子守恒以及电荷守恒可知反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。②没有230mL容量瓶,则配制时所需玻璃仪器为250mL容量瓶、玻璃棒、烧杯、胶头滴管等。③消耗高锰酸钾是0.002mol,根据方程式可知参加反应的草酸是0.005mol,因此样品的纯度为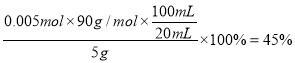 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】能正确表达下列反应的离子方程式为( )
A.用醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O
B.硫化亚铁与浓硫酸混合加热:2H++FeS=H2S↑+ Fe2+
C.向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3 ![]() =Al2(CO3)3↓
=Al2(CO3)3↓
D.用氢氧化钠溶液吸收工业废气中的NO2:2NO2+2OH= ![]() +
+ ![]() + H2O
+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定质量的均匀固体混合物Cu、Cu2O和 CuO,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少6.40g,另一份中加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为
A. 3.6mol/L B. 3.2mol/L C. 2.8mol/L D. 2.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.再加入10mL pH=11的NaOH溶液,混合液pH=7
C.醋酸的电离程度增大,c(H+)亦增大
D.溶液中 ![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2015·上海)氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。完成下列填空: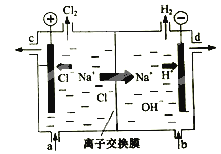
已知: H2SO3 Ki1=1.54×10-2 Ki2=1.02×10-7
HClO Ki1=2.95×10-8
H2CO3 Ki1=4.3×10-7 Ki2=5.6×10-11
(1)写出电解饱和食盐水的离子方程式。
(2)离子交换膜的作用为: 、 。
(3)精制饱和食盐水从图中 位置补充,氢氧化钠溶液从图中 位置流出。(选填“a”、“b”、“c”或“d”)
(4)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2 , 还生成CO2和KHSO4等物质。
写出该反应的化学方程式
(5)室温下,0.1 mol/L NaClO溶液的pH 0.1 mol/L Na2SO3溶液的pH。(选填“大于”、“小于”或“等于”)。
浓度均为0.1 mol/L 的Na2SO3和Na2CO3的混合溶液中,SO32–、CO32–、HSO3–、HCO3– 浓度从大到小的顺序为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事故处理措施正确的是
A. 实验用剩的试剂都不能放回原试剂瓶,以防污染试剂
B. 在气体发生装置上直接点燃甲烷气体时,必须先检验甲烷的纯度
C. 如果少量酒精失火燃烧,立即用水浇灭
D. 眼睛里溅进盐酸,立即用 NaOH 溶液洗涤眼睛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1mol/L的氨水中加入少量的NH4Cl固体, 溶液的pH(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度(填“增 大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和2H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 , 平衡常数表达式为;若有1mol硝酸铵完全分解,转移的电子数为mol。
(3)由N2O、H2O反应生成N2和NO2的能量变化如图所示,若生成1molN2 , 其△H= kJ/mol。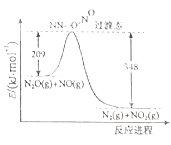
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com