
| H2CO3 | K${\;}_{{a}_{1}}$=4.3×10-7 | HClO | Ka=2.95×10-8 |
| K${\;}_{{a}_{2}}$=5.61×10-11 | AgCl | Ksp=1.77×10-10 | |
| CH3COOH | Ka=1.76×10-5 | Ag2CrO4 | Ksp=1.12×10-12 |
| I | Ⅱ | Ⅲ | Ⅳ | |
| FeCl3溶液体积/mL | 100 | 100 | 100 | 100 |
| 加入粉末质量/g | 3 | 6.6 | 9 | 12 |
| 剩余粉末质量/g | 0 | 0.64 | 3.2 | 6.4 |
分析 (1)向FeBr2溶液中滴加少量氯水,氯气会将亚铁离子和溴离子氧化;铁离子的检验用硫氰化钾溶液;
(2)①弱酸的酸性越弱,其酸根越易结合氢离子;
②析出沉淀时,AgCl溶液中c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$,Ag2CrO4溶液中c(Ag+)=$\sqrt{\frac{Ksp(A{g}_{2}Cr{O}_{4})}{c(Cr{{O}_{4}}^{-})}}$,c(Ag+)越小,则越先生成沉淀;
(3)2mol•L-1的FeCl3溶液中,加入铁、铜组成的均匀粉末状混合物,先是金属铁和氯化铁之间的反应,金属铁消耗完毕后,是金属铜和氯化铁之间的反应,根据提供数据结合金属的反应先后顺序来回答判断.
解答 解:(1)向FeBr2溶液中滴加少量氯水,氯气会将亚铁离子和溴离子氧化,产物分别是铁离子和溴单质,铁离子在溶液中呈现浅黄色,所以使溶液变黄的微粒铁离子的是铁离子,检验铁离子可以用硫氰化钾溶液,溶液会变红色,故答案为:Fe3+;取适量反应后的溶液滴加KSCN溶液变红;
(2)①弱酸的酸性越弱,其酸根越易结合氢离子,根据表中数据,平衡常数越小,对应弱酸的酸性越弱,越易结合氢离子,所以等物质的量浓度的Na2CO3、CH3COONa、NaClO组成的混合溶液中逐滴加入稀硫酸,首先发生反应的离子方程式是CO32-+H+=HCO3-,故答案为:CO32-+H+=HCO3-;
②析出沉淀时,AgCl溶液中c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$=$\frac{1.56×1{0}^{-10}}{0.01}$=1.56×10-8,Ag2CrO4溶液中c(Ag+)=$\sqrt{\frac{Ksp(A{g}_{2}Cr{O}_{4})}{c(Cr{{O}_{4}}^{-})}}$=$\sqrt{\frac{9.0×1{0}^{-12}}{0.01}}$=3×10-5,氯离子和铬酸根离子的浓度是相等的,c(Ag+)越小,则越先生成沉淀,所以种阴离子产生沉淀的先后顺序为Cl->CrO42-,故答案为:AgCl;
(3)①根据后三组数据可以看出,多加入金属的质量和多剩余金属的质量之比是一定值,所以最后应该是金属铁完全消耗,金属铜剩余,铁离子完全反应的情况,所以粉末中铁、铜的物质的量相等,物质的量之比为1:1,故答案为:1:1;
②加入金属铁和金属铜,没有金属剩余,金属铁和氯化铁反应一定会产生亚铁离子,铜和铁离子之间反应一定会生成铜离子和亚铁离子,根据第二组数据,加入金属混合物6.6g,剩余金属是0.64g,所以加入3g金属时,铁离子还会剩余,故Ⅰ反应后的溶液中存在的金属阳离子有:Fe3+、Fe2+、Cu2+.
故答案为:Fe3+、Fe2+、Cu2+.
点评 本题综合考查学生混合物组成的计算、电解池的工作原理、沉淀溶解平衡的计算等知识,属于综合知识的考查,难度不大.


科目:高中化学 来源: 题型:解答题
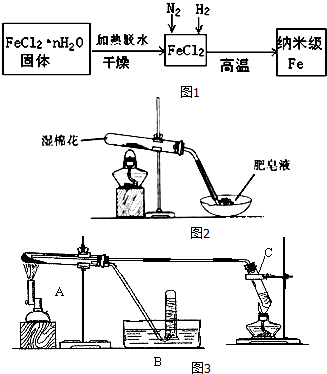
| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 将反应后得到黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
| Ⅱ | 向实验I中得到的溶液滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铝溶于氢氧化钠溶液:Al+2OH-═2AlO2-+H2↑ | |
| B. | NaHCO3溶液与硫酸氢钠溶液混合:HCO3-+H+═H2O+CO2↑ | |
| C. | 过氧化钠与水反应:Na2O2+2H2O═2Na++2OH-+O2↑ | |
| D. | Ca(OH)2溶液中通入过量CO2:Ca2++2OH-+CO2═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 工业上制取漂白粉:向澄清石灰水中通入足量的Cl2 | |
| B. | 验证醋酸是弱电解质:常温下测定0.1 mol•L-1醋酸或醋酸钠溶液的pH | |
| C. | 探究FeCl3和KI溶液反应限度:向5mL0.1 mol•L-1KI溶液中加入0.1 mol•L-1 FeCl3溶液1mL,振荡,加苯萃取后,向水层中加入5滴KSCN溶液,观察实验现象 | |
| D. | 检验蔗糖水解生成的葡萄糖:蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
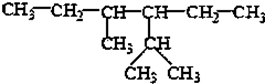 的系统命名为2,4-二甲基-3-乙基乙烷.
的系统命名为2,4-二甲基-3-乙基乙烷.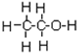 乙烯的电子式
乙烯的电子式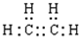
 <
<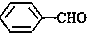
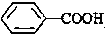 >CH3COOH(提示:类比酚和醇的酸性)
>CH3COOH(提示:类比酚和醇的酸性)查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe (OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高空臭氧层吸收太阳紫外线,保护地球生物;反应3O2=2O3有单质参加,属于氧化还原反应 | |
| B. | 人造纤维,合成纤维和光导纤维都是有机高分子化合物 | |
| C. | 加热能杀死流感病毒是因为病毒的蛋白质受热变性 | |
| D. | 钢铁在海水中比在河水中更易被腐蚀,主要原因是海水含氧量高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M2+的离子半径比N3-小 | B. | M的原子序数比N小 | ||
| C. | M与N原子的电子层数相同 | D. | M与N的最外层电子数相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com