
有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4mol/L,SO42﹣的物质的量浓度为0.7mol/L,则此溶液中K+的物质的量浓度为( )
|
| A. | 0.1mol/L | B. | 0.15mol/L | C. | 0.2mol/L | D. | 0.25mol/L |
考点:
物质的量浓度的相关计算;电解质在水溶液中的电离.
专题:
守恒法.
分析:
根据溶液呈电中性原则,溶液中应满足:3c(Al3+)+c(K+)+c(H+)=2c(SO42﹣)+c(OH﹣),由于溶液中c(H+)和c(OH﹣)很小,可忽略不计,则有3c(Al3+)+c(K+)=2c(SO42﹣),以此解答该题.
解答:
解:溶液呈电中性,则满足:3c(Al3+)+c(K+)+c(H+)=2c(SO42﹣)+c(OH﹣),
由于溶液中c(H+)和c(OH﹣)很小,可忽略不计,则有3c(Al3+)+c(K+)=2c(SO42﹣),
所以有3×0.4mol/L+c(K+)=2×0.7mol/L,
c(K+)=2×0.7mol/L﹣3×0.4mol/L=0.2mol/L,
故选C.
点评:
本题考查溶液浓度的计算,题目难度不大,注意从溶液电中性的角度计算溶液离子浓度.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
下列变化过程,属于放热过程的是()
①液态水变成水蒸气; ②酸碱中和反应; ③浓H2SO4稀释;
④固体氢氧化钠溶于水; ⑤H2在Cl 2中燃烧; ⑥弱酸电离;
2中燃烧; ⑥弱酸电离;
⑦NH4Cl晶体与Ba(OH )2•8H2O混合搅拌.
A. ①③⑤ B. ①⑥⑦ C. ②④⑦ D. ②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
向某盛有7.8gNa2O2的密闭容器中(无空气)通入4.48LNO2(标准状况),然后注入200mL水,充分反应后,容器中所含物质有()
A. NaNO2 NO H2O
B. NaNO3 NaOH O2 H2O
C. NaNO3 H2O
D. NaNO3 HNO3 O2 H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中滴入BaCl2溶液,产生白色沉淀,再滴入稀盐酸,沉淀不溶解,则该溶液中( )
|
| A. | 一定有SO42﹣ | B. | 还可能有CO32﹣ |
|
| C. | 一定无Ag+ | D. | 可能有SO42﹣或Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
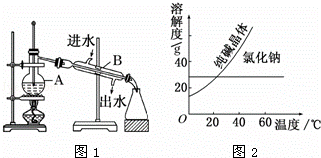
如图为实验室制取蒸馏水的装置示意图,回答下列问题:
(1)图中有两处明显的错误是:
① ;② 冷却水进口、 .
(2)A仪器的名称是 ,B仪器的名称是 .
(3)实验时A中除加入少量自来水外,还需要加入少量的 ,其作用是 .
(4)阅读、分析下列两个材料:
材料1:材料2:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g/cm | 溶解性 |
| 乙二醇(C2H6O2) | ﹣11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、乙醇以任意比互溶 |
回答下列问题(填写序号):
A.蒸馏法 B.萃取法 C.“溶解、结晶、过滤”的方法 D.分液法
将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用 .将乙二醇和丙三醇分离的最佳方法是 .(填写A﹣D序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质的稀溶液相互反应,把前者逐滴滴入后者与把后者逐滴滴入前者,所产生的现象不相同的是( )
①AlCl3和NaOH ②Na2CO3和HCl ③NaHCO3和HCl ④NaCl和AgNO3.
|
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A为金属单质,它们之间能发生如下反应(部分产物未标出)
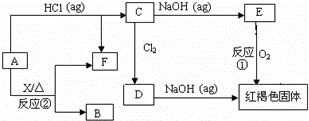
请根据以上信息回答下列问题:
(1)写出物质B、D的化学式:
(2)写出下列反应的化学方程式:
反应① ;
反应② .
查看答案和解析>>
科目:高中化学 来源: 题型:
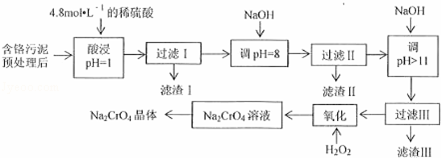
某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺流程如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Mg2+):
已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO42﹣形式存在且易氧化;
②常温下,部分阳离子以氢氧化物形式沉淀是溶液的pH如下:
阳 Fe Mg Al Cr
开始沉淀时的H 1.9 9.0 ﹣﹣ ﹣﹣
沉淀完全时的H 3. 11.1 8 9(>9溶解)
(1)实验室用18.4mol•L﹣1的浓硫酸配制250mL 4.8mol•L﹣1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需量 ;
(2)滤渣II是 ,过滤II步骤能否省略,为什么?
.
(3)写出滤液中加入H2O2发生反应的两种方程式 ;
(4)取得到的Na2CrO4晶体0.48g,加入硫酸溶液得到Na2CrO溶液,用0.3000 mol•L﹣1滴定至终点时(铬被还原为Cr3+),消耗20.00mL标准溶液.
①盛装FeSO4标准溶液应用酸式滴定管(填“酸式”或“碱式”),滴定时的操作为:
②计算该产品中Na2CrO4的质量分数为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com