
在2A+B  3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A.v(B)=0.3 mol·L-1·s-1
B.v(A)=0.5 mol·L-1·s-1
C.v(C)=0.6 mol·L-1·s-1
D.v(D)=1 mol·L-1·s-1
科目:高中化学 来源:2014-2015学年福建省高一上学期期中化学试卷(解析版) 题型:选择题
配制0.1 mol·L-1的硫酸500mL,最适宜的一组仪器是
A.托盘天平、烧杯、容量瓶、玻璃棒
B.烧杯、玻璃棒、胶头滴管、量筒
C.烧杯、500mL容量瓶、玻璃棒、胶头滴管
D.烧杯、500mL容量瓶、玻璃棒、胶头滴管、量筒
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高二上学期月考化学理试卷(解析版) 题型:填空题
如图装置,A、B中电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹;电源有a、b两极。若在A、B中充满KOH溶液后倒立于KOH溶液的水槽中,
切断K1,闭合K2、K3,通直流电,则:

(1)标出电源的正、负极,a为________极。
(2)在湿的Na2SO4滤纸条中心滴KMnO4溶液,现象为___________________________。
(3)写出电极反应式:A中_____________________________________。
(4)若电解一段时间,A、B中均有气体包围电极。此时切断K2、K3,闭合K1。电流表的指针偏转,则此时A极电极反应式为____________ ______________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高二上学期月考化学理试卷(解析版) 题型:选择题
已知下列反应的热化学方程式:
① C(金刚石,s) + O2(g) === CO2(g) ΔH1
② C(石墨,s) + O2(g) === CO2(g) ΔH2
③ C(石墨,s) === C(金刚石,s) ΔH3=1.9 kJ/mol
则下列说法正确的是
A.石墨转化成金刚石的反应是吸热反应
B.金刚石比石墨稳定
C.ΔH3=ΔH1-ΔH2
D.ΔH1>ΔH2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高二上学期月考化学理试卷(解析版) 题型:选择题
下列四个选项是在不同的情况下对化学反应A(g) + 3B(g)  2C(g) + 2D(g) 测得用不同物质表示的反应速率,其中表示该化学反应的反应速率最快的是
2C(g) + 2D(g) 测得用不同物质表示的反应速率,其中表示该化学反应的反应速率最快的是
A.v(D) = 0.6 mol·L-1·min-1 B.v(B) = 0.45 mol·L-1·s-1
C.v(C) = 0.40 mol·L-1·min-1 D.v(A) = 0.2 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高二上学期期中化学(文)试卷(解析版) 题型:选择题
下列实例没有应用蛋白质变性的是
A.重金属盐中毒的病人服用鸡蛋清解毒
B.高温消毒医疗器械
C.用甲醛的水溶液保存标本
D.把生理盐水静脉注射到人体内
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高二上学期期中化学(文)试卷(解析版) 题型:选择题
室温下的溶液中,在强碱性溶液中不能大量共存的离子组是
A.Ba2+、Na+、NO3-、Br-
B.K+、Na+、SO32-、S2-
C.K+、Na+、AlO2-、SO42-
D.NH4+、Cu2+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高一上学期期中化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.纯净物一定由分子构成
B.混合物肯定由两种以上元素组成
C.同种分子构成的物质一定是纯净物
D.含有氧元素的化合物都是氧化物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:填空题
(12分)工业上以铬铁矿(主要成分FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O)的主要反应如下:
① 4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
② 2Na2CrO4+H 2SO4 Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
(1)工业上反应①需不断搅拌,其目的是 。
(2)下图是红矾钠(Na2Cr2O7·2H2O)和Na2SO4的溶解度曲线。
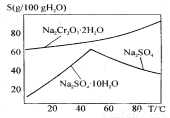
从Na2Cr2O7和 Na2SO4的混合溶液中提取Na2Cr2O7晶体的操作:
先将混合溶液蒸发结晶,趁热过滤。趁热过滤的目的是 ;然后将滤液 ,从而析出红矾钠。
(3)Na2Cr2O7与KCl进行复分解反应可制取K2Cr2O7,现用重铬酸钾测定铁矿石中铁的含量,测定原理为:Fe2++Cr2O72-+H+ Fe3++ Cr3+ +7H2O (未配平)
Fe3++ Cr3+ +7H2O (未配平)
实验步骤如下:
步骤1:将m g铁矿石加浓盐酸加热溶解 步骤2:加入SnCl2溶液将Fe3+还原
步骤3:将所得溶液冷却,加入HgCl2溶液,将过量的Sn2+氧化为Sn4+
步骤4:加入15 mL硫酸和磷酸的混合酸及5滴0.2%二苯胺磺酸钠指示剂
步骤5:立即用c mol·L-1重铬酸钾溶液滴定至溶液呈稳定紫色,即为终点,消耗重铬酸钾溶液V mL
①如省去步骤③,则所测定的铁的含量 (填“偏高”、“偏低”或“无影响”)。
②步骤5使用的主要玻璃仪器有 。
③则测定铁矿石中铁的含量的计算式为 (用字母表示,不用化简)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com