��ѧ����Դ��������������ʮ�ֹؼ������ã�������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϣ�
��1����298K��101kPaʱ��2g H
2��ȫȼ������Һ̬ˮ���ų�285.8kJ���������ʾ����ȼ���ȵ��Ȼ�ѧ����ʽΪ��
H
2��g��+
O
2��g��=H
2O��l����H=-285.8kJ/mol
H
2��g��+
O
2��g��=H
2O��l����H=-285.8kJ/mol
��
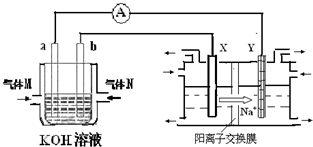
����ȼ�ϵ������ת���ʸߣ����й����ķ�չǰ������������ȼ�ϵ�ؽ�����ͼ����ʳ��ˮ���ʵ�飨ͼ�����õ缫��Ϊ���Ե缫����������װ�á��ش��������⣺
��2������ȼ�ϵ���У�a�缫Ϊ��ص���
����
����
�����������������������M�ķ���ʽ
H2
H2
��a�缫�Ϸ����ĵ缫��ӦʽΪ��
H2+OH--2e-=2H2O
H2+OH--2e-=2H2O
��
��3��������ͼװ����ʢ��100mL5.0mol/LNaCl��Һ�����һ��ʱ��������10.0mol/L������Һ50mL���ܶ�Ϊ1.02g/mL������ʹ��Һ�ָ���ԭ��״̬�����ڴ˵������е�����ת�Ƶĵ�����Ϊ
4.14
4.14
mol��������С�����2λ��
�������Ǻϳɰ�����Ҫԭ�ϣ���ҵ�Ϻϳɰ��ķ�Ӧ�ǣ�
N
2��g��+3H
2��g��?2NH
3 ��g����H=-92.2kJ?mol
-1��4��������ʵ�У�����˵���������淴Ӧ�Ѿ��ﵽƽ�����
�ۢ�
�ۢ�
��
��N
2��H
2��NH
3������������ٸı䣻
�ڵ�λʱ��������2n mol NH
3��ͬʱ����3n mol H
2��
�۵�λʱ��������3n mol N-H����ͬʱ����n mol N��N��
����N
2��H
2��NH
3�����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ����֮��Ϊ1��3��2��
�ݻ�������ƽ��Ħ���������ٸı䣻
�������������ʵ������ٸı䣮
��5����֪�ϳɰ���Ӧ��ij�¶���2.00L���ܱ������з�Ӧ������������ݣ�
| ���ʵ���/��mol��/ʱ�䣨h�� |
0 |
1 |
2 |
3 |
4 |
| N2 |
1.50 |
n1 |
1.20 |
n3 |
1.00 |
| H2 |
4.50 |
4.20 |
3.60 |
n4 |
3.00 |
| NH3 |
0.00 |
0.20 |
n2 |
1.00 |
1.00 |
���ݱ������ݼ��㣺
�ٷ�Ӧ���е�2Сʱʱ�ų�������Ϊ
27.7
27.7
kJ��
��0��1Сʱ��N
2��ƽ����Ӧ����
0.05
0.05
mol?L
-1?h
-1��
�۴������¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K�T
0.15
0.15
��������λС������
�ܷ�Ӧ�ﵽƽ�������ƽ����ϵ���ټ���N
2��H
2 ��NH
3��1mol����ѧƽ����
����Ӧ
����Ӧ
�����ƶ��������Ӧ�����淴Ӧ�����ƶ�������





 ������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϣ�
������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϣ� ��ѧ����Դ��������������ʮ�ֹؼ������ã�������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϣ�
��ѧ����Դ��������������ʮ�ֹؼ������ã�������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϣ� ��ѧ����Դ����������������ʮ�ֹؼ������ã�������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϣ�
��ѧ����Դ����������������ʮ�ֹؼ������ã�������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϣ�