
”¾ĢāÄæ”æ2Zn(OH)2”¤ZnCO3ŹĒÖʱø»īŠŌZnOµÄÖŠ¼äĢ壬ŅŌŠæ±ŗÉ°(Ö÷ŅŖ³É·ÖĪŖZnO£¬ŗ¬ÉŁĮæCu2+”¢Mn2+µČĄė×Ó)ĪŖŌĮĻÖʱø2Zn(OH)2”¤ZnCO3µÄ¹¤ŅÕĮ÷³ĢČēĻĀ£ŗĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ()

A. µ±(NH4)2SO4£¬NH3”¤H2OµÄ»ģŗĻČÜŅŗ³ŹÖŠŠŌŹ±£¬c(NH4+) = 2c(SO42-)
B. ”°½žČ””±Ź±ĪŖĮĖĢįøߊæµÄ½ž³öĀŹ£¬æɲÉČ”µÄ“ėŹ©ŹĒ½Į°č”¢ŹŹµ±¼ÓČČ
C. ”°½žČ””±Ź±¼ÓČėµÄNH3”¤H2O¹żĮæ£¬Éś³ÉMnO2µÄĄė×Ó·½³ĢŹ½ĪŖMn2++H2O2+2NH3”¤H2O=MnO2+2NH4++2H2O
D. ”°¹żĀĖ¢ó”±ĖłµĆĀĖŅŗæÉŃ»·Ź¹ÓĆ£¬ĘäÖ÷ŅŖ³É·ÖµÄ»ÆѧŹ½ŹĒNH4HCO3
”¾“š°ø”æD
”¾½āĪö”æ
Öʱø2Zn£ØOH£©2ZnCO3Į÷³ĢĪŖ£ŗŠæ±ŗÉ°£ØÖ÷ŅŖ³É·ÖĪŖZnO£¬ŗ¬ÉŁĮæCu2+”¢Mn2+µČĄė×Ó£©ÖŠ¼ÓČėĮņĖįļ§”¢°±Ė®”¢Ė«ŃõĖ®£¬Ė«ŃõĖ®½«ĆĢĄė×ÓŃõ»Æ³É¶žŃõ»ÆĆĢ£¬¹żĀĖŗóŌŚĀĖŅŗÖŠ¼ÓĮņ»Æļ§£¬ŌŁ¹żĀĖ£¬³żČ„ĶĄė×Ó£¬Õō°±³żČ„¶ąÓąµÄ°±Ęų£¬¼ÓČėĢ¼ĖįĒāļ§µĆµ½2Zn£ØOH£©2ZnCO3ŗĶ¶žŃõ»ÆĢ¼ĘųĢ壬¹żĀĖµĆ2Zn£ØOH£©2ZnCO3£¬ĀĖŅŗĪŖĮņĖįļ§ČÜŅŗ£¬¾Ż“Ė“šĢā”£
A.£ØNH4£©2SO4ÓėNH3H2OµÄ»ģŗĻČÜŅŗÖŠ“ęŌŚµēŗÉŹŲŗć£ŗc £ØNH4+£©+c£ØH+£©=2c£ØSO42-£©+c£ØOH-£©£¬25”ꏱ£¬pH=7ŹĒĻŌÖŠŠŌµÄČÜŅŗ£¬¹Źc£ØH+£©=c£ØOH-£©£¬ĖłŅŌc£ØNH4+£©=2c£ØSO42-£©£¬¹ŹAÕżČ·£»
B.øł¾ŻÓ°Ļģ·“Ó¦ĖŁĀŹµÄŅņĖŲÅŠ¶Ļ”°½žČ””±Ź±ĪŖĮĖĢįøߊæµÄ½ž³öĀŹ£¬æɲÉČ”µÄ“ėŹ©ĪŖ½Į°č”¢ŹŹµ±¼ÓČČ£¬¹ŹBÕżČ·£»
C.”°½žČ””±Ź±¼ÓČėµÄNH3H2O¹żĮ棬ČÜŅŗ³Ź¼īŠŌ£¬Ė«ŃõĖ®½«ĆĢĄė×ÓŃõ»Æ³ÉMnO2£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖMn2++H2O2+2NH3H2O=MnO2”ż+2NH4++2H2O£¬¹ŹCÕżČ·£»
D.”°¹żĀĖ3”±ĖłµĆĀĖŅŗĪŖĮņĖįļ§ČÜŅŗ£¬æÉŃ»·Ź¹ÓĆ£¬Ęä»ÆѧŹ½ĪŖ£ØNH4£©2SO4£¬¹ŹD“ķĪó”£
¹ŹŃ”D”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ°“ŅŖĒóĢīæÕ
£Ø1£©ŅŅ“¼Ķ¬·ÖŅģ¹¹ĢåµÄ½į¹¹¼ņŹ½__________£¬“ÅĢśæóÖ÷ŅŖ³É·ÖµÄ»ÆѧŹ½__________£»
£Ø2£©ĀČĘųŗĶĖ®·“Ó¦µÄĄė×Ó·½³ĢŹ½____________________________________________£»
£Ø3£©ĀĮŗĶĒāŃõ»ÆÄĘČÜŅŗ·“Ó¦µÄ»Æѧ·½³ĢŹ½____________________________________£»
£Ø4£©Ģ¼ĖįĒāÄʵĵēĄė·½³ĢŹ½________________________________________________£»
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æNH3 ×÷ĪŖŅ»ÖÖÖŲŅŖ»Æ¹¤ŌĮĻ£¬±»“óĮæÓ¦ÓĆÓŚ¹¤ŅµÉś²ś£¬ÓėĘäÓŠ¹ŲŠŌÖŹ·“Ó¦µÄ “߻ƼĮŃŠ¾æŌų±»ĮŠČė¹ś¼Ņ 863 ¼Ę»®”£
(1)“߻ƼĮ³£¾ßÓŠ½ĻĒæµÄŃ”ŌńŠŌ£¬¼“×ØŅ»ŠŌ”£ŅŃÖŖ£ŗ·“Ó¦ I £ŗ4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g)”÷H= 905.0 kJ”¤mol-1 ·“Ó¦ II : 4NH3(g)+3O2(g)
4NO(g) +6H2O(g)”÷H= 905.0 kJ”¤mol-1 ·“Ó¦ II : 4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) ”÷H= 1266.6 kJ”¤mol-1 Š“³ö NO ·Ö½āÉś³É N2 Óė O2 µÄČČ»Æѧ·½³ĢŹ½_________”£
2N2(g) +6H2O(g) ”÷H= 1266.6 kJ”¤mol-1 Š“³ö NO ·Ö½āÉś³É N2 Óė O2 µÄČČ»Æѧ·½³ĢŹ½_________”£
(2)ŌŚŗćĪĀŗćȯװÖĆÖŠ³äČėŅ»¶ØĮæµÄ NH3 ŗĶ O2,ŌŚÄ³“߻ƼĮµÄ×÷ÓĆĻĀ½ųŠŠ·“Ó¦ I ,²āµĆ²»Ķ¬Ź± ¼äµÄ NH3 ŗĶ O2,µÄÅضČČēĻĀ±ķ£ŗ
Ź±¼ä(min) | 0 | 5 | 10 | 15 | 20 | 25 |
c(NH3)/mol”¤L1 | 1.00 | 0.36 | 0.12 | 0.08 | 0.072 | 0.072 |
c(O2)/mol L1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
ŌņĻĀĮŠÓŠ¹ŲŠšŹöÖŠÕżČ·µÄŹĒ_____”£
A£®Ź¹ÓĆ“ß»Æ¼ĮŹ±£¬æɽµµĶøĆ·“Ó¦µÄ»ī»ÆÄÜ£¬¼ÓæģĘä·“Ó¦ĖŁĀŹ
B£®Čō²āµĆČŻĘ÷ÄŚ 4v Õż(NH3) =6v Äę(H2O)Ź±£¬ĖµĆ÷·“Ó¦ŅŃ“ļĘ½ŗā
C£®µ±ČŻĘ÷ÄŚn(NO)/n(NH3)=1 Ź±£¬ĖµĆ÷·“Ó¦ŅŃ“ļĘ½ŗā
D£®Ē° 10 ·ÖÖÓÄŚµÄĘ½¾łĖŁĀŹ v( NO)=0.088 mol”¤L-1”¤min-1
(3)Öʱø“߻ƼĮŹ±³£²śÉśŅ»¶ØµÄ·ĻŅŗ£¬¹¤ŅµÉĻ³£ĄūÓĆĒāĮņĖį¼ģ²āŗĶ³żČ„·ĻŅŗÖŠµÄ Cu2+”£ ŅŃÖŖ£ŗ25”ꏱ£¬K1(H2S) =1.3”Į107£¬K2(H2S) =7.1”Į1015£¬Ksp(CuS) =8.5”Į1045
¢ŁŌŚ¼ĘĖćČÜŅŗÖŠµÄĄė×ÓÅØ¶ČŹ±£¬Éę¼°ČõĖįµÄµēĄėĶس£ŅŖ½ųŠŠ½üĖĘ“¦Ąķ”£Ōņ 0.lmol L1 ĒāĮņ ĖįµÄ pH”Ö______(Č”½üĖĘÕūŹż)”£
¢ŚÄ³Ķ¬Ń§Ķعż½üĖĘ¼ĘĖć·¢ĻÖ 0.lmol L1 ĒāĮņĖįÓė 0.0lmol L1 ĒāĮņĖįÖŠµÄ c(S2)ĻąµČ£¬¶ųĒŅ µČÓŚ_____mol”¤L1
¢ŪŅŃÖŖ£¬Ä³·ĻŅŗ½Ó½üÓŚÖŠŠŌ£¬Čō¼ÓČėŹŹĮæµÄĒāĮņĖį£¬µ±·ĻŅŗÖŠ c(Cu2+) >_____mol”¤L1(¼ĘĖć ½į¹ū±£ĮōĮ½Ī»ÓŠŠ§Źż×Ö)£¬¾Ķ»į²śÉś CuS ³Įµķ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æļ®æÕĘų³äµēµē³ŲÓŠĶū³ÉĪŖµē¶ÆĘū³µµÄŹµÓĆ“¢ÄÜÉč±ø”£¹¤×÷ŌĄķŹ¾ŅāĶ¼ČēĻĀ£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ
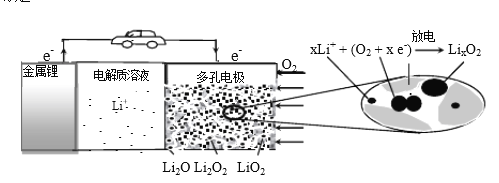
A. øƵē³Ų¹¤×÷Ź±Li+Ļņøŗ¼«ŅʶÆ
B. Li2SO4ČÜŅŗæÉ×÷øƵē³Ųµē½āÖŹČÜŅŗ
C. µē³Ų³äµēŹ±¼äŌ½³¤£¬µē³ŲÖŠLi2O ŗ¬ĮæŌ½¶ą
D. µē³Ų¹¤×÷Ź±£¬Õż¼«æÉ·¢Éś: 2Li+ +O2+ 2e-=Li2O2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČēĶ¼ŹĒŅŌĒ¦Šīµē³ŲĪŖµēŌ“£¬Ä£ÄāĀČ¼ī¹¤Ņµµē½ā±„ŗĶŹ³ŃĪĖ®µÄ×°ÖĆĶ¼£ØC”¢D¾łĪŖŹÆÄ«µē¼«£©”£µē½āŅ»¶ĪŹ±¼äŗó£¬ČōŌŚµē½ā³ŲÖŠC¼«Ņ»²ą³öĄ“µÄĘųĢåĪŽÉ«ĪŽĪ¶£¬D¼«Ņ»²ą³öĄ“µÄĘųĢå³Ź»ĘĀĢÉ«ÓŠ“Ģ¼¤ŠŌĘųĪ¶”£Ēė»Ų“šŅŌĻĀĪŹĢā£ŗ

£Ø1£©ŅŃÖŖĒ¦Šīµē³ŲŌŚ·ÅµēŹ±·¢ÉśµÄ·“Ó¦£ŗPb+PbO2+4H++2SO42-=2PbSO4+2H2O£¬ŌņA¼«µÄµē¼«·“Ó¦ĪŖ___________________________£»
£Ø2£©µē½ā±„ŗĶŹ³ŃĪĖ®µÄĄė×Ó·“Ó¦·½³ĢŹ½ŹĒ__________________£»
£Ø3£©µē¼«CµÄµē¼«·“Ó¦ŹĒ_____________________________________________£»
£Ø4£©µē½āŹ±ĪŖ·ĄÖ¹Į½ÖÖĘųĢå²śĪļ»ģŗĻ£¬ÓĆŃōĄė×Ó½»»»Ä¤×öøōĤ”£Ōņµē½āŹ±Na+“Ó______¼«ĒųŅĘĻņ_____¼«Ēų£ØĢī”°C”±»ņ”°D”±£©£»
£Ø5£©ČōµēĀ·ÉĻÓŠ0.2molµē×ӵĵēĮæĶعż£¬ŌņĒ¦Šīµē³ŲÖŠĻūŗÄĮņĖį_________mol”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚ²»Ķ¬ĒéæöĻĀ²āµĆA(g)£«3B(g)![]() 2C(g)£« 2D(s)µÄĻĀĮŠ·“Ó¦ĖŁĀŹ£¬ĘäÖŠ·“Ó¦ĖŁĀŹ×ī“óµÄŹĒ
2C(g)£« 2D(s)µÄĻĀĮŠ·“Ó¦ĖŁĀŹ£¬ĘäÖŠ·“Ó¦ĖŁĀŹ×ī“óµÄŹĒ
A. ¦Ō(D)=0.01 molL-1s-1 B. ¦Ō(C)=0.010 molL-1s-1
C. ¦Ō(B)=0.6 molL-1min-1 D. ¦Ō(A)=0.2molL-1min-1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£Ø¼ÓŹŌĢā£©NH4Al(SO4)2”¤12H2O(ļ§Ć÷·Æ)æÉÓĆ×÷ÅŻÄĆš»šĘ÷µÄÄŚĮō¼Į”¢ŹÆÓĶĶŃÉ«¼ĮµČ”£Ä³ŠĖȤŠ”×éĶ¬Ń§ÓĆŃõ»ÆĢś”¢ĀĮ·Ū”¢Ć¾ĢõŗĶĀČĖį¼ŲµČĪļÖŹ×öĀĮČČ·“Ó¦ŗóµÄĀĮ»Ņ¼°ĮņĖįļ§µČĪŖŌĮĻÖʱøļ§Ć÷·ÆµÄŹµŃ飬²½ÖčČēĻĀ£ŗ
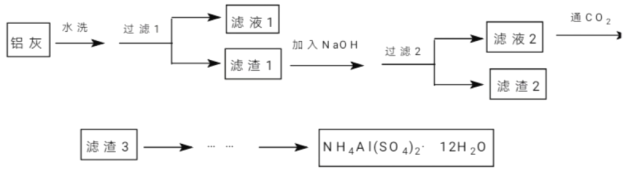
(1)ĻĀĮŠÓŠ¹ŲĖµ·ØÖŠÕżČ·µÄŹĒ_________”£
A£®”°ĀĖŅŗ1”±ÖŠŗ¬ÓŠK+”¢Mg2+”¢Cl-
B£®”°ĀĖŌü1”±ŗĶ”°ĀĖŌü2”±ÖŠŗ¬ÓŠĻąĶ¬µÄĪļÖŹ
C£®”°¹żĀĖ1”±æÉÓĆĒćĪö·Ø£¬ŅŌĖõ¼õŹµŃ鏱¼ä
D£®½«”°ĀĖŅŗ3”±Õōøɲ¢×ĘÉÕ£¬æɵƓæ¼ī
(2)ÓĆNaOHČܽā”°ĀĖŌü1”±Ź±£¬æÉŅŌ²ÉÓĆ_________µÄ·½Ź½Ģįøß½ž³öĀŹ(Š“³ö3Ģõ)”£
(3)Ļņ”°ĀĖŅŗ2”±ÖŠĶØČė×ćĮæµÄCO2£¬Š“³öĻąÓ¦µÄĄė×Ó·“Ó¦·½³ĢŹ½__________________”£
(4)ÓÉ”°ĀĖŌü3”±Öʱøļ§Ć÷·Æ£¬¾¹żČēĻĀ²½Öč£ŗa”śg”ś_________”śh(ŅĄ“ĪĢīČėÕżČ·µÄŠņŗÅ)
a£®¼ÓĮņĖįČܽā b£®³éĀĖ
c£®¼ÓČėÕō·¢ĆóÖŠ
d£®½µĪĀ½į¾§
e£®Õō·¢ÖĮ±ķĆę³öĻÖ¾§Ä¤
f£®ÅäÖʱ„ŗĶĮņĖįļ§ČÜŅŗ
g£®½«ĮņĖįĀĮČÜŅŗ×ŖŅĘÖĮÕō·¢Ćó
h£®Ļ“µÓ”¢øÉŌļ
(5)¢Łøł¾Żø÷ĪļÖŹµÄČܽā¶ČĒśĻß(¼ūĻĀĶ¼)£¬ŌŚ80”ꏱ£¬ÓĆŅ»¶ØÅØ¶ČµÄĮņĖįČܽā”°ĀĖŌü3”±Ź±£¬×īŹŹŅĖµÄĮņĖįÅضČĪŖ_________”£

A£®3mol/L(1.20g/mL)
B£®6mol/L(1.34g/mL)
C£®9mol/L(1.49 g/mL)
D£®18mol/L (1.84g/mL)
¢ŚĖłŠčĮņĖįÓĆĮæµÄ¼ņ±ćČ·¶Ø·½·ØŹĒ__________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æø»ÅšŌüÖŠŗ¬ÓŠĆ¾ÅšĖįŃĪ£Ø2MgO”¤B2O3£©”¢Ć¾¹čĖįŃĪ£Ø2MgO”¤SiO2£©¼°ÉŁĮæAl2O3”¢FeOµČŌÓÖŹ”£ÓÉø»ÅšŌüŹŖ·ØÖʱøĮņĖįĆ¾¾§ĢåŗĶÅšĖį£ØH3BO3£©¾§ĢåµÄŅ»ÖÖ¹¤ŅÕĮ÷³ĢČēĻĀ£ŗ

ŅŃÖŖ£ŗÉś³ÉĒāŃõ»ÆĪļ³ĮµķµÄpH£Ø½šŹōĄė×ÓµÄĘšŹ¼ÅضČĪŖ0.1mol/L£©
Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | |
æŖŹ¼³ĮµķŹ± | 1.9 | 3.4 | 7.0 | 9.1 |
ĶźČ«³ĮµķŹ± | 3.2 | 4.7 | 9.0 | 11.1 |
£Ø1£©ÉĻŹöĮ÷³ĢÖŠÄܼÓæģ·“Ó¦ĖŁĀŹµÄ“ėŹ©ÓŠ______”¢_______µČ”£
£Ø2£©Ėį½žŹ±·¢Éś·“Ó¦£ŗ2MgO”¤SiO2 + 2H2SO4=2MgSO4 + SiO2 + 2H2O£¬2MgO”¤B2O3+ 2H2SO4 + H2O=2H3BO3 + 2MgSO4”£
¢ŁÉĻŹö·“Ó¦ĢåĻÖ³öĖįŠŌĒæČõ£ŗH2SO4______H3BO3£ØĢī”°£¾”±»ņ”°£¼”±£©”£
¢Ś Ėį½žŹ±£¬ø»ÅšŌüÖŠĖłŗ¬Al2O3ŗĶFeOŅ²Ķ¬Ź±Čܽā£¬Š“³öĻą¹Ų·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ______”¢______”£
¢Ū ŅŃÖŖÅšĖįÓė¹żĮæNaOHČÜŅŗ·¢ÉśµÄÖŠŗĶ·“Ó¦ĪŖ£ŗH3BO3 + OH- B(OH)4-”£ĻĀĮŠ¹ŲÓŚÅšĖįµÄĖµ·ØÕżČ·µÄŹĒ__£ØĢīŠņŗÅ£©”£
a. ÅšĖįŹĒŅ»ŌŖĖį
b. ĻņNaHCO3¹ĢĢåÖŠµĪ¼Ó±„ŗĶÅšĖįČÜŅŗ£¬ÓŠĘųÅŻ²śÉś
c. ÅšĖįµÄµēĄė·½³ĢŹ½æɱķŹ¾ĪŖ£ŗH3BO3 + H2O![]() B(OH)4-+H+
B(OH)4-+H+
£Ø3£©¼ģŃéŗÖÉ«½ž³öŅŗÖŠµÄŌÓÖŹĄė×Ó£ŗȔɣĮ潞³öŅŗ£¬______£ØĢī²Ł×÷ŗĶĻÖĻ󣩣¬Ö¤Ć÷ČÜŅŗÖŠŗ¬ÓŠFe2+”£
£Ø4£©³żČ„½ž³öŅŗÖŠµÄŌÓÖŹĄė×Ó£ŗ ÓĆMgOµ÷½ŚČÜŅŗµÄpHÖĮ______ŅŌÉĻ£¬Ź¹ŌÓÖŹĄė×Ó×Ŗ»ÆĪŖ______£ØĢī»ÆѧŹ½£©³Įµķ£¬¹żĀĖ”£
£Ø5£©»ńČ”¾§Ģå£ŗ¢”.ÅØĖõĀĖŅŗ£¬Ź¹MgSO4ŗĶH3BO3½Ó½ü±„ŗĶ£»¢¢.æŲÖĘĪĀ¶ČŹ¹Į½ÖÖ¾§Ģå·Ö±š“ÓČÜŅŗÖŠ½į¾§”£½įŗĻĻĀĶ¼Čܽā¶ČĒśĻߣ¬¼ņŹö¢¢µÄ·½·Ø£ŗ½«ÅØĖõŅŗ¼ÓČėµ½øßŃ¹øŖÖŠ£¬______£Ø½«·½·Ø²¹³äĶźÕū£©”£

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĄė×Ó·½³ĢŹ½ÕżČ·µÄŹĒ
A. KClO ¼īŠŌČÜŅŗÓė Fe(OH)3 ·“Ó¦£ŗ3ClO+2Fe(OH)3=2FeO42+3Cl+4H++H2O
B. ÓĆĻ”ĮņĖį³żČ„ĮņĖįÄĘČÜŅŗÖŠÉŁĮæµÄĮņ“śĮņĖįÄĘ£ŗS2O32- +2H+= SO2”ü+S”ż+H2O
C. Ó²Ö¬ĖįÓėŅŅ“¼µÄõ„»Æ·“Ó¦£ŗC17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
D. ĻņĢ¼ĖįĒāļ§ČÜŅŗÖŠ¼ÓČė×ćĮæŹÆ»ŅĖ®£ŗCa2++HCO3-+OH-=CaCO3”ż+H2O
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com