
【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(1)原子半径最小的元素是____(填元素名称),写出⑧的原子结构示意图______。
(2)最高价氧化物对应的水化物中,碱性最强的是___(用化学式回答,下同),酸性最强的是___。
(3)①与⑤形成的化合物中,化学键类型为_____。
(4)⑦与⑨形成的化合物的电子式为___,②与④形成的原子个数比为1:2的化合物的结构式为____。
(5)③、④、⑥的原子半径由大到小的顺序为_____(用元素符号回答)。
(6)为探究元素②和⑧的非金属性强弱,某同学设计了如图所示的装置进行实验(夹持仪器已略去,装置气密性良好)。请回答:
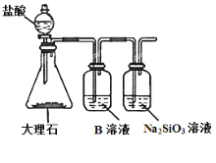
a.溶液B的作用是_______
b.若看到____现象,即可证明酸性_______(用化学式回答),则非金属性_______(用元素符号回答)。
c.上述实验中,能说明②和⑧非金属性强弱的化学方程式是_____________。
【答案】氢 ![]() NaOH HClO4 共价键
NaOH HClO4 共价键 ![]() O=C=O Na>N >O 除去CO2气体中的HCl Na2SiO3溶液中产生白色胶状沉淀(或Na2SiO3溶液变浑浊) H2CO3 > H2SiO3 C > Si Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓或Na2SiO3+2CO2+2H2O=2NaHCO3+H2SiO3↓
O=C=O Na>N >O 除去CO2气体中的HCl Na2SiO3溶液中产生白色胶状沉淀(或Na2SiO3溶液变浑浊) H2CO3 > H2SiO3 C > Si Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓或Na2SiO3+2CO2+2H2O=2NaHCO3+H2SiO3↓
【解析】
由元素在周期表中的位置可知,①为H、②为C、③为N、④为O、⑤为F、⑥为Na、⑦为Mg、⑧为Si、⑨为Cl。
(1)原子核外电子层数越少,原子半径越小;根据Si原子核外各个电子层含有的电子数目确定原子的结构示意图;
(2)元素的金属性越强,其最高价氧化物对应的水化物的碱性越强;元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强;
(3)非金属元素的原子间形成共价键;
(4)活泼的金属与非金属元素形成离子键,②与④形成的原子个数比为1:2的化合物CO2分子中C原子与2个O原子形成四个共价键,据此书写;
(5)同一周期的元素,原子序数越大原子半径越小;不同周期的元素,原子核外电子层数越多,原子半径越大;
(6)用盐酸与大理石反应制取CO2气体,盐酸具有挥发性,用饱和NaHCO3溶液除去CO2在的HCl杂质气体,然后将CO2通入Na2SiO3溶液中,若看到产生白色沉淀,就证明酸性碳酸>硅酸,也就证明了元素的非金属性C>Si。
根据元素在周期表的位置可知:①为H、②为C、③为N、④为O、⑤为F、⑥为Na、⑦为Mg、⑧为Si、⑨为Cl。
(1)原子核外电子层数越少,原子半径越小,在上述元素中H原子核外只有1个电子层,H原子半径最小;Si是14号元素,核外电子排布为2、8、4,所以Si原子结构示意图为![]() ;
;
(2)元素的金属性越强,其最高价氧化物对应的水化物的碱性越强;在上述元素中金属性最强的元素的Na元素,所以碱性最强的为NaOH;元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强,在上述元素中F元素非金属性最强,但是F元素无最高正化合价,在上述元素形成的含氧酸中,酸性最强的为HClO4;
(3)①与⑤分别表示H、F,两种都是非金属元素,二者形成的化合物HF中,化学键类型为共价键;
(4)⑦与⑨形成的化合物MgCl2是离子化合物,2个Cl-与Mg2+通过离子键结合,故MgCl2的电子式为![]() ;②与④形成的原子个数比为1:2的化合物CO2是共价化合物,C原子与2个O原子形成4个共价键,因此CO2的结构式为O=C=O;
;②与④形成的原子个数比为1:2的化合物CO2是共价化合物,C原子与2个O原子形成4个共价键,因此CO2的结构式为O=C=O;
(5)③、④、⑥表示的元素分别是N、O、Na,N、O是第二周期的元素,Na是第三周期的元素,由于不同周期的元素,原子核外电子层数越多,原子半径越大,所以Na原子半径最大;N、O是第二周期的元素,原子序数O>N,由于同一周期的元素,原子序数越大原子半径越小,所以原子半径N>O,故三种元素的的原子半径由大到小的顺序为Na>N>O;
(6)在锥形瓶中用盐酸与大理石反应制取CO2气体,由于盐酸具有挥发性,在装置B中用饱和NaHCO3溶液除去CO2在的HCl杂质气体,发生反应HCl+NaHCO3=NaCl+CO2↑+H2O,然后将除杂后的CO2气体通入Na2SiO3溶液中,发生反应:Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓,看到产生了白色沉淀,证明了酸性:碳酸>硅酸,由于元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强,所以同时证明了元素的非金属性C>Si。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】以下有关氨气的叙述中不正确的是( )
A.潮湿的氨气可以用浓硫酸干燥
B.氨的喷泉实验体现了氨的溶解性
C.氨具有还原性,一定条件下可与氧气发生反应
D.实验室里可用氨水与生石灰制取少量氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是一种重要的化工产品,目前硫酸的主要生产方法是“接触法”,其主要反应之一为2SO2+O2![]() 2SO3。下列有关该反应的说法不正确的是( )
2SO3。下列有关该反应的说法不正确的是( )
A.SO2和O2不可能全部转化为SO3
B.达到平衡后,反应就停止了,故正、逆反应速率相等且均为零
C.该反应从开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等
D.工业上生产SO3时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol/LKOH溶液滴定10mL0.1mol/LHA溶液的滴定曲线如图所示。下列说法不正确的是( )
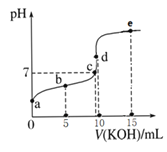
A.a点pH约为3,可以判断HA是弱酸
B.b点溶液:c(A-)>c(K+)>c(HA)>c(H+)>c(OH-)
C.c点溶液:c(K+)=c(A-)
D.水的电离程度:c点>d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组设计了如图所示的装置制取乙酸乙酯(图中夹持仪器和加热装置已略去)。已知下列数据:
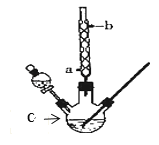
乙醇 | 乙酸 | 乙酸乙酯 | 98%浓硫酸 | |
熔点/℃ | ﹣117.3 | 16.6 | ﹣83.6 | |
沸点/℃ | 78.5 | 117.9 | 77.5 | 338.0 |
请回答下列问题:
(1)仪器C的名称为______,球形冷凝管的作用是_____。
(2)向C中加入反应物,待充分反应后,将C中的混合物倒入装有饱和碳酸钠溶液的烧杯中充分振荡洗涤。饱和碳酸钠溶液作用是(填字母):_____
A.中和乙酸并溶解乙醇
B.碳酸钠溶液呈碱性,有利于乙酸乙酯的水解
C.加速乙酸乙酯的生成,提高其产率
D.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
(3)经多次振荡洗涤、静置分液后,为了进一步提纯乙酸乙酯,可采用蒸馏的方法,蒸馏时控制温度在__左右,温度计的水银球应位于____。
(4)若实验所用乙酸质量为2.4g,乙醇质量为2.1g,得到纯净的产品质量为2.64g,则乙酸乙酯的产率是______。
(5)乙酸乙酯与氢氧化钠溶液发生反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知活性氧可以把SO2快速氧化为SO3,根据计算机模拟结果,在炭黑表面上O2转化为活化氧的反应历程与能量变化关系如图所示。下列说法正确的是
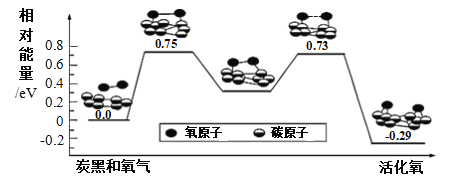
A.O2转化为活化氧与碳氧键生成无关
B.每活化1个O2分子最终吸收0.29 eV能量
C.该过程的最大能垒(活化能)E正= 0.73 eV
D.炭黑可加快SO2转化为SO3的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是一些工厂和矿山废水中的污染元素,使用吸附剂是去除水中砷的有效措施之一。
(1)将硫酸锰、硝酸钇与氢氧化钠溶液按一定比例混合,搅拌使其充分反应,可获得一种砷的高效吸附剂X,吸附剂X中含有![]() ,其原因是_______________________________。
,其原因是_______________________________。
(2)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如题20图- 1和题20图- 2所示。

①以酚酞为指示剂(变色范围pH 8.0 ~ 10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为__________________。
②H3AsO4第一步电离方程式H3AsO4![]() H2AsO4-+H+的电离常数为Ka1,则pKa1=______(p Ka1 = -lg Ka1 )。
H2AsO4-+H+的电离常数为Ka1,则pKa1=______(p Ka1 = -lg Ka1 )。
(3)溶液的pH对吸附剂X表面所带电荷有影响。pH =7.1时, 吸附剂X表面不带电荷; pH > 7.1时带负电荷,pH越高,表面所带负电荷越多;pH<7.1时带正电荷,pH越低,表面所带正电荷越多。pH不同时吸附剂X对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X吸附砷的质量)如题20图-3所示。

①在pH7~9之间,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降,其原因是______________。
②在pH4~7之间,吸附剂X对水中三价砷的去除能力远比五价砷的弱,这是因为___________。 提高吸附剂X对三价砷去除效果可采取的措施是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaBr、NaI、Na2SO3混合液中,通入一定量氯气后,将溶液蒸干并灼烧,得到固体剩余物质的组成可能是( )
A.NaCl、NaBr、Na2SO4B.NaCl、Na2SO4、Br2
C.NaCl、Na2SO4、I2D.NaCl、NaI、Na2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com