
| A. | Na2CO3 | B. | NaOH | ||
| C. | CH3COONa NaOH | D. | Na2CO3 CH3COONa |
分析 醋酸与氢氧化钠反应生成醋酸钠溶液,醋酸根水解生成醋酸和氢氧化钠溶液,加热蒸干促进醋酸根离子水解,醋酸挥发得到的氢氧化钠溶液,氢氧化钠吸收空气中的二氧化碳生成碳酸钠溶液,据此判断解答.
解答 解:醋酸与氢氧化钠反应生成醋酸钠溶液,醋酸根水解生成醋酸和氢氧化钠溶液,加热蒸干促进醋酸根离子水解,醋酸挥发得到的氢氧化钠溶液,氢氧化钠吸收空气中的二氧化碳生成碳酸钠溶液,碳酸钠加热时会发生水解,生成氢氧化钠和碳酸氢钠,但随着水的不断减小,溶液增大,水解的程度减小,且碳酸氢钠与氢氧化钠会相互反应生成碳酸钠和水,所以最终得到的是碳酸钠,
故选:A.
点评 本题考查了元素化合物知识,明确盐类水解的规律及应用是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | 该电池放电时,正极的电极反应为O2+4H++4e-═2H2O | |
| B. | 该电池充电时,阴极发生了氧化反应:Li++e-═Li | |
| C. | 电池中的有机电解液可以用稀盐酸代替 | |
| D. | 正极区产生的LiOH可回收利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
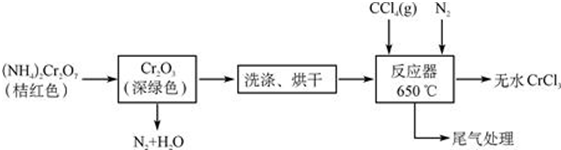
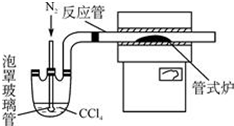
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
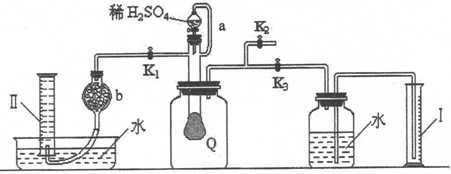
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
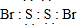 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提出原子结构模型的科学家按时间先后依次是:道尔顿、卢瑟福、汤姆生、玻尔 | |
| B. | 借助仪器来分析化学物质的组成是常用的手段,原子吸收光谱常用来确定物质中含有哪些非金属元素 | |
| C. | 地球上大量的溴蕴藏在大海中,因此溴被称为“海洋元素” | |
| D. | 新制氯水应保存在无色试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:7 | B. | 3:4 | C. | 4:7 | D. | 1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 外观澄清、稳定 | B. | 分散质粒子直径为1---100nm | ||
| C. | 分散至粒子能透过半透膜 | D. | 丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液一定呈酸性 | |
| B. | 该溶液中c(H+)可能等于10-5 mol•L-1 | |
| C. | 该溶液的pH可能为4也可能为10 | |
| D. | 该溶液有可能呈中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com