
质量分数为a%,物质的量浓度为c mol/L 的KOH溶液,蒸发溶剂,恢复到原来温度,若质量分数变为2a%,则物质的量浓度变为()
A. 大于2c mol/L B. 等于2c mol/L
C. 小于2c mol/L D. 在c mol/L∽2c mol/L之间
考点: 物质的量浓度的相关计算.
专题: 物质的量浓度和溶解度专题.
分析: 氢氧化钾溶液浓度越大密度越大,令质量分数为a%KOH溶液的密度为xg/ml,质量分数为2a%KOH溶液的密度为yg/ml,根据c=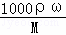 表示质量分数为a%KOH溶液及质量分数为2a%KOH溶液的物质的量浓度,据此结合密度x<y判断.
表示质量分数为a%KOH溶液及质量分数为2a%KOH溶液的物质的量浓度,据此结合密度x<y判断.
解答: 解:令质量分数为a%KOH溶液的密度为xg/ml,质量分数为2a%KOH溶液的密度为yg/ml,则:
质量分数为a%KOH溶液的物质的量浓度为c=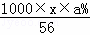 mol/L;
mol/L;
质量分数为2a%KOH溶液的物质的量浓度为c′=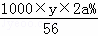 mol/L,
mol/L,
氢氧化钾溶液浓度越大密度越大,所以x<y,故c′>2c.
故选:A.
点评: 考查物质的量浓度计算、物质的量浓度与质量分数关系等,难度不大,理解物质的量浓度定义.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
实验室需用400mL 1.0mol/L的NaOH溶液,若用NaOH固体来配制.可供选择的仪器有100mL、250mL、500mL和1000mL四种不同规格的容量瓶,烧杯,托盘天平,药匙,100mL的量筒.还缺少的必要仪器是 ,需称取NaOH固体的质量是20g.
查看答案和解析>>
科目:高中化学 来源: 题型:
在0℃和1×105 Pa下,用铂电极电解硫酸铜溶液,当阴极产生6.4g铜时,阳极放出()
A. 1.12L氧气 B. 1.12L氢气 C. 2.24L氢气 D. 2.24L氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生用0.2000mol•L﹣1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④移取20.00mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞试液;
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答:
(1)以上步骤有错误的是(填编号) ,若测定结果偏高,其原因可能是 .
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(2)判断滴定终点的现象是: .
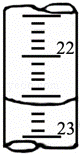
(3)如图是某次滴定时的滴定管中的液面,其读数为 .
(4)根据下列数据:请计算待测盐酸溶液的浓度: mol/L.
滴定次数 待测体积(mL) 标准烧碱体积(mL)
滴定前读数 滴定后读数
第一次 20.00 0.40 20.40
第二次 20.00 2.00 24.10
第三次 20.00 4.00 24.00
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子组在一定条件下能大量共存,当加入相应试剂后会发生化学变化,且所给离子方程式正确的是()
选项 离子组 加入试剂 加入试剂后发生反应的离子方程式
A Fe2+、NO3﹣、K+ 稀硫酸 3Fe2++NO3﹣+4H+═3Fe3++NO↑+2H2O
B Fe3+、I﹣、ClO﹣ 氢氧化钠溶液 Fe3++3OH﹣═Fe(OH)3↓
C Ba2+、HCO3﹣、Cl﹣ 氢氧化钠溶液 HCO3﹣+OH﹣═CO+H2O
D Al3+、Cl﹣、NO3﹣ 过量氢氧化钠溶液 Al3++3OH﹣═Al(OH)3↓
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
雾霾严重影响人们的生活与健康,某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42﹣、NO3﹣、Cl﹣.某同学收集了该地区的雾霾,经必要的预处理后的试样溶液,设计并完成了如下实验:
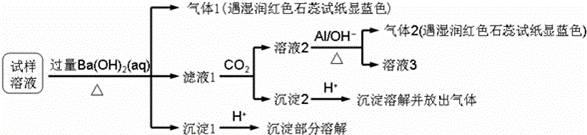
已知:3NO3﹣+8Al+5OH﹣+2H2O 3NH3↑+8AlO2﹣
3NH3↑+8AlO2﹣
根据以上的实验操作和现象,该同学得出的结论不正确的是()
A. 试样中肯定存在NH4+、Mg2+、SO42﹣和NO3﹣
B. 试样中一定不含Al3+
C. 试样中可能存在Na+、Cl﹣
D. 该雾霾中可能存在NaNO3、NH4Cl和MgSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中,属于强电解质的是 (填序号,下同);属于弱电解质的是 ;属于非电解质的是 .
①氨气②氨水③盐酸④醋酸(CH3COOH)⑤硫酸钡⑥氯化银⑦氯化钠溶液⑧二氧化碳⑨醋酸铵⑩氢气.
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下的密闭容器中,反应2SO2(g)+O2(g)⇌2SO3(g)达到平衡.缩小容器容积,对反应产生影响的叙述不正确的是()
A. 使平衡常数K增大
B. 使平衡向正反应方向移动
C. 使SO3的浓度增大
D. 使正反应速率大于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度.(可供选用的反应物只有CaCO3固体、6mol/L盐酸、6mol/L硫酸和蒸馏水)
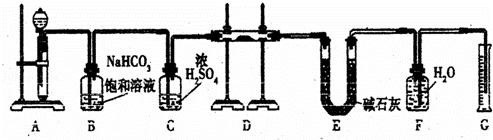
回答下列问题:
(1)装置A中液体试剂选用 ,理由是 .
(2)装置B的作用是 .装置C的作用是 .装置E中碱石灰的作用是 .
(3)装置D中发生反应的化学方程式是 .
(4)若开始时测得样品的质量为2.0g,反应结束后测得气体体积为224mL(标准状况),则Na2O2试样的纯度 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com