
【题目】干电池原理如图所示,电池总反应为Zn+2NH4+═Zn2++2NH3↑+H2↑.下列说法正确的是( ) 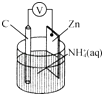
A.碳电极上发生还原反应
B.Zn极上发生还原反应
C.常见锌锰干电池为二次电池
D.负极上发生的反应为2NH4++2e﹣═2NH3↑+H2↑
【答案】A
【解析】解:A.放电时,Zn元素化合价由0价变为+2价、H元素化合价由+1价变为0价,所以Zn是负极、C是正极,正极发生还原反应,故A正确; B.Zn电极上失电子发生氧化反应,电极反应式为Zn﹣2e﹣=Zn2+ , 故B错误;
C.常见锌锰干电池不能充放电,所以属于一次电池,故C错误;
D.Zn是负极、C是正极,正极反应式为2NH4++2e﹣=2NH3↑+H2↑,负极反应式为Zn﹣2e﹣=Zn2+ , 故D错误;
故选A.
该装置是原电池,根据电池反应式知,放电时,Zn元素化合价由0价变为+2价、H元素化合价由+1价变为0价,所以Zn是负极、C是正极,负极反应式为Zn﹣2e﹣=Zn2+ , 正极反应式为2NH4++2e﹣=2NH3↑+H2↑,以此解答该题.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化. 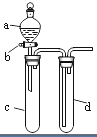
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是 .
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸,c中反应的化学方程式是 .
方案 | 反应物 |
甲 | Cu、浓HNO3 |
乙 | Cu、稀HNO3 |
丙 | Cu、O2、稀HNO3 |
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是 .
(4)该小组还用上述装置进行实验证明酸性:HCl>H2CO3>H2SiO3 , 则分液漏斗a中加入的试剂是 , c中加入的试剂是 , d中加入的试剂是;实验现象为 . 但此实验存在不足之处,改进的措施是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含少量KCl、K2SO4、K2CO3杂质的KNO3溶液,选择适当的试剂除去杂质,得到纯净的KNO3固体,实验流程如图所示
注:KNO3固体容易受热分解;HNO3易挥发.
(1)沉淀A的主要成分是、(填化学式).
(2)②中反应的化学方程式是 .
(3)③进行的实验操作是(填操作名称).
(4)③加入过量的K2CO3溶液的目的是 .
(5)为了除去溶液3中的杂质,可向其中加入适量的 . 从此溶液获得KNO3晶体的操作是、、过滤.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各组离子中,能大量共存的( )
A.Ag+、NO3﹣、Na+、Cl﹣
B.K+、HCO3﹣、Cl﹣、Al3+
C.NO3﹣、Fe2+、H+、Br﹣
D.K+、Cl﹣、SO42﹣、NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氧化铝和氢氧化铝的说法正确的是( )
A. 氧化铝是一种比较好的耐火材料,可用来制造耐火坩埚
B. 氧化铝是典型的两性氧化物,可与氨水反应生成四羟基合铝酸盐
C. 因为氢氧化铝受热易分解,所以具有两性
D. 两性氢氧化物只能与强酸、强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式错误的是( )
A.NaHCO3═Na++H++CO ![]()
B.NaHSO4(溶液)═Na++H++SO ![]()
C.MgCl2═Mg2++2Cl﹣
D.Ba(OH)2═Ba2++2OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中甲曲线表示在最适温度下,某种酶促反应速率与反应物浓度之间的关系。其余两条曲线分别表示该酶促反应的反应速率受温度和pH的影响情况。回答下列问题:

(1)甲曲线中,若在A点适当提高温度,反应速率将会_____________________;在B点适当增加酶的浓度,反应速率将会__________________。
(2)丙曲线中,H点代表该酶的_____________________。
(3)若想要短期保存该酶,应选择曲线中的________点所对应的温度。
(4)探究温度对酶活性的影响时,通常选择_________________________(填“淀粉酶”或“过氧化氢酶”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某厂废水中含KCN,其浓度为0.01molL﹣1 , 现用氯氧化法处理,发生如下反应(化合物中N化合价均为﹣3价):
(1)KCN+2KOH+Cl2═KOCN+2KCl+H2O被氧化的元素是 . (用元素符号表示)
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:
KOCN+Cl2+═K2CO3+N2+KCl+ .
(3)若将10L含KCN的浓度为0.01molL﹣1的废水中KCN氧化除去,最少需要氯气mol.
(4)某实验小组为了测定(3)中溶液多余Cl2的含量,常用Na2S2O3标准溶液进行定量测定.现实验室需用480mL一定浓度的Na2S2O3溶液,配制该溶液所需玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外,还需
(5)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42﹣ , 因此Na2S2O3常用作脱氯剂,该反应的离子方程式为 .
(6)现取(3)中溶液20.00mL,用amolL﹣1 Na2S2O3溶液进行滴定,经过平行实验测得消耗Na2S2O3标准溶液b mL,计算废液中Cl2的浓度为molL﹣1 (用含a、b的表达式表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com